Результаты анализа крови у свиней

Сергей Ушаков, кандидат ветеринарных наук, технолог ЗАО «Консул»
Биохимический и клинический анализы крови – одни из распространенных и доступных диагностических методов исследований. Кровь – это динамическая система, отражающая все изменения, происходящие в организме животного под действием физиологических и патологических факторов. В настоящее время в лабораторную диагностику внедрены автоматические и полуавтоматические методики биохимических и общих клинических методов исследования крови, снизив при этом погрешность получаемых результатов. Однако человеческий фактор в проведении анализа крови остается решающим при:
- Заборе крови
- Транспортировке и хранении образцов
- Пробоподготовке перед проведением анализа
- Выборе метода исследования
- Трактовке полученных результатов
Каждый из этих этапов имеет определенный уровень погрешности, который складывается в суммарную погрешность. Чтобы свести ее к минимуму, необходимо знать некоторые особенности при отборе и транспортировке проб крови. Во-первых, кровь необходимо отбирать в вакуумные или шприц-пробирки, не допуская вспенивания, падения капель крови на дно, она должна набираться по стенке пробирки. Во-вторых, необходимо определиться, для каких исследований будет использована кровь, нужно ли ее стабилизировать. В настоящее время на рынке присутствуют пробирки с антикоагулянтом, шариками на дне для ускорения свертываемости крови. Во многих хозяйствах антикоагулянт вводят самостоятельно (при отсутствии условий точного взвешивания или определения объема), что может приводить к чрезмерному разведению крови, либо недостаточному внесению антикоагулянта и образованию небольших сгустков – все это является одной из причин получения ложных результатов общего клинического анализа. Использование шприц-пробирок с антикоагулянтом исключает возможность ошибки при его внесении. Однако остается вероятность неравномерного смешивания крови с антикоагулянтом. Считается, что после отбора крови пробирку необходимо плавно перевернуть не менее 10 раз.
Если кровь планируется использовать для приготовления мазков и выведения лейкоформулы, желательно это сделать в течение первого часа, оптимально – сразу после отбора. Если кровь поступает в пробирку, происходит перераспределение форменных элементов и нейтрофильная группа оседает на ее стенках.
Для биохимических исследований сыворотки крови отобранный образец стабилизировать не нужно, но необходимо отделить сыворотку в течение первых 2-х часов. В противном случае можно получить ложные результаты по аминотрансферазам, лактатдегидрогеназе, щелочной фосфатазе, меди, фосфору, железу, калию и хлоридам.
Определенные требования предъявляются к доставке проб сыворотки крови. Они должны быть помещены в термобокс при температуре 4 градуса, если планируется проведение исследований через сутки, если позже 24 часов, пробы необходимо заморозить при -20 градусах.
Данные рекомендации актуальны при проведении биохимических исследований сыворотки крови на практически любой анализируемый показатель. Если пробы отбираются целенаправленно, например, для анализа количества витаминов или микро- макроэлементов, или общего белка, альбуминов, мочевины – условия отбора и транспортировки могут изменяться сугубо под эти показатели. Возникает вопрос, для чего следовать указаниям по отбору и транспортировке проб? Ответ прост – мы анализируем не абсолютные, а относительные показатели и наша задача – получить результат при одинаковых условиях. В данном случае, если мы сравниваем полученный результат с нормами, мы должны знать, при каких условиях были получены эти нормы и сделать все аналогично. Поэтому каждое диагностическое учреждение должно предоставлять рекомендации по отбору и транспортировке проб крови, которым необходимо четко следовать. В идеале эти рекомендации должны быть унифицированы и одинаковы для каждого диагностического учреждения. На практике этого не наблюдается. Каждая лаборатория использует свои методы исследования и свои нормы для интерпретации полученных результатов (табл. 1, 2, 3).
Таблица 1. Нормативные показатели в сыворотке крови взрослых свиней отдельных лабораторий Беларуси и России

Таблица 2. Нормативные показатели сыворотки крови свиноматок отдельных лабораторий Беларуси

Таблица 3. Нормативные показатели биохимического состава крови для поросят в возрасте 50 дней

Как видно из табличных данных, нормативные показатели отличаются, и иногда существенно. Эти различие допускается при использовании для определения показателя различных методов исследований, но разница между референсными величинами должна находиться в пределах погрешности метода исследований. На сегодняшний день при определении нормативных показателей отдельные лаборатории учитывают физиологическое состояние животного, его возраст, но не учитывают генетические особенности, т.е. межпородные различия, а они иногда бывают существенными (Табл. 4).
Таблица 4. Биохимические показатели крови свиней в возрасте 10-12 недель в зависимости от породы

DL – немецкий ландрас, DE – немецкий йоркшир, Pietrain – петрен, Hybrid – помесные породы.
Из этой таблицы следует, что мясные породы свиней отличаются от материнских прежде всего уровнем белкового обмена, что видно по таким показателям, как мочевина, креатинин, общий белок, альбумины, кроме того у них протекает быстрее метаболизм, требующий активного участия ферментов.
Основываясь на результатах лабораторных биохимических исследований крови животных в различных хозяйствах Республики Беларусь, в особенности в передовых, регистрируется повышенный уровень креатинина, мочевины, общего белка, альбуминов. Если полученные результаты сравнить с приведенными выше немецкими нормами, то они находятся в пределах референсных величин. Передовые хозяйства РБ активно занимаются селекционной работой, у некоторых имеется нуклеус, включающий йоркшира и ландраса, закупаются чистопородные хряки – дюрок, петрен. Назрела необходимость выведения норм именно для этих животных.
Другой вопрос состоит в том, что ни одна лаборатория при проведении биохимических исследований не учитывает проведение ветеринарных обработок, которые оказывают влияние на биохимические показатели. В каждом хозяйстве схема индивидуальна и непрерывна, включает в себя вакцинации, витаминно-минеральные обработки, подкислители, ферменты в комбикормах, антибиотикотерапию, на некоторых комплексах готовят лечебные комбикорма, в которых присутствуют постоянно антибиотик, антгельминтики и т.д. В медицинской практике известно около 4500 лекарственных средств, которые влияют на биохимические показатели крови. В таблице 5 представлены некоторые лекарственные вещества, влияющие на биохимический состав крови животных. Так, например, известно, что практически все антибиотики увеличивают уровень креатинина в крови, введение декстранов увеличивает уровень глюкозы и т.д.
Таблица 5. Влияние некоторых препаратов на биохимические показатели крови животных

В заключениях лабораторий часто проводится индивидуальный анализ по каждой пробе, что является недопустимым. Целью биохимического исследования является определение среднего значения для поголовья хозяйства. Если, например, в хозяйстве отобрали кровь от 5 свиноматок, на комплексе их, к примеру, 1800. Что нам нужно узнать – какие изменения в крови у 5 животных или рассчитать средний показатель для 1800 животных с определением критерия достоверности полученных результатов? Исходя из этого, при анализе результаты необходимо статистически обрабатывать, определяя среднее значение показателя и его ошибку. Это позволит вычислить процент поголовья животных, для которых полученный показатель будет характерен. Стоит заметить, что чем больше выборка животных, у которых отбирается кровь, тем более достоверные результаты будут получены. Считается, что для получения более-менее адекватных значений биохимического исследования крови животных, количество проб должно быть не менее 7 от каждой исследуемой физиологической группы (при условии отсутствия в них гемолиза).
Заключение
Так или иначе, каждый специалист решает сам, проводить или нет биохимический и общий клинический анализы крови в той или иной лаборатории. Ясно одно, что в современных условиях результаты биохимического исследования крови не могут адекватно отражать качество кормления и сбалансированность рациона. В этом случае более достоверными данными оценки уровня обмена веществ и интенсивности роста животного является среднесуточный прирост, уровень лактации (для свиноматок), масса поросят к отъему, сдаточный вес, выход мяса с туши, категорийность и т.д. Эти показатели определяются с учетом данных всего поголовья. Если они адекватны реализации генетического потенциала поголовья, то в проведении биохимического исследования крови нет необходимости. В противном случае пробы крови должны отбираться квалифицированно, с соблюдением правил отбора, о которых говорилось выше, и доставляться в лабораторию в кратчайшие сроки.
Литературные источники
- Ветеринарная клиническая патология/ Джексон М. – 384 с.
- Мейер, Д. Ветеринарная лабораторная медицина. Интерпритация и диагностика /Д. Мейер, Дж. Харви // Перевод с англ. – М.: Софион, 2007. – 456 с.
- Schweinekrankheiten / K. Heinritzi, H.R. Gindele, G. Reiner, U. Schnurrbusch / Verlag eugen ulmer Stutgart. – 2006. – 480 p.
- Swine Nutrition Guide: 2 nd / Y.F. Patience et all. – 2001. – 271 p.
- Wartości referencyjne podstawowych badań laboratoryjnych w weterynarii/ A. Winicrka. – Warchawa. – 1997. – 115 s.
Источник
| Биохимические показатели | Ед. изм. | Свиноматки | Поросята | |
| Новорожден-ные до кормления | 4-6 дни жизни | |||
| Сыворотки крови Белок общий | г% | 7,5-8,5 | 2,5-3,5 | 5,2-6,3 |
| Гамма-глобулин | г% | 1,8-2,5 | 0-0,32 | 1,0-1,2 |
| Альбумины | г% | 3,0-3,4 | ||
| Кальций общий | мг% | 10-12 | 10-13 | 10-13 |
| Фосфор неорганический | мг% | 5,0-7,0 | 5,0-9,5 | 5,0-8,0 |
| Мочевина | мг% | 30,0-40,0 | ||
| Активность щелочной фосфатазы | ед. Бод. | 1,0-2,0 | 3,0-15 | 3,0-15 |
| Витамин А | мкг% | 20-40 | 10-40 | 10-80 |
| Витамин Е | мг% | 0,25-0,70 | 0,25-1,2 | 0,25-1,2 |
| Витамин В3 | мкг% | 70-85 | 44-70 | |
| Витамин С | мг% | 0,5-0,7 | 0,2-1,0 | 0,2-1,0 |
| Витамин В12 | ммкг/мл | 0,2-0,4 | ||
| Железо в сыворотке | мкг% | 160,0-200,0 | ||
| Йод (СБЙ) | мкг% | 4,0-6,0 | ||
| Цельная кровь Гемоглобин | г% | 10-12 | 8-10 | 8-12 |
| Эритроциты | млн/мкл | 5,0-6,0 | 4,5-6,5 | 4,5-6,5 |
| Гематокрит | 38-46 | 30-46 | 30-46 | |
| Скорость оседания эритроцитов (СОЭ) | мм/час | 15,0-25,0 | ||
| Лейкоциты | тыс/мкл | 12-16 | 8-12 | 10-15 |
| Кетоновые тела | мг% | 1,0-2,0 | ||
| Витамин В12 | мкг% | 10-15 | 10-25 | 10-12 |
| Витамин В2 | мкг% | 5,0-10,0 | 5,0-20,0 | 5-25 |
| Глюкоза | мг% | 60-80 | 80-120 | 80-120 |
| Фосфор неорганический | мг% | 5,0-7,0 | ||
| Медь | мкг% | 80-100 | 110-140 | 70-100 |
| Цинк | мкг% | 200-300 | 110-140 | 100-150 |
| Марганец | мкг% | 10-20 | 10-16 | 12-18 |
| Кобальт | мкг% | 4,0-6,0 | 5-8,5 | 2,3-5,3 |
| Магний | мг% | 3,4,0 | ||
| Печень Витамин А | мг% | 4,0-15,0 | 0,6-0,9 | 0,4-1,2 |
Справочное приложение № 2
Оптимальные параметры микроклимата для свиней.
| № пп | Параметры микроклимата | Свино-матки первого периода супорос-ности и холос-тые | Свино-матки второго периода супорос-ности | Свино-матки подсос-ные | Порося-та-отъемы-шы | Свиньи на откорме |
| 1. | Температура, 0С | |||||
| 2. | Относительная влажность, % | |||||
| 3. | Скорость движения воздуха, м/сек: В холодный и переходный период года | 0,3 | 0,15 | 0,15 | 0,2 | 0,3 |
| В теплый период года | 1,0 | 1,0 | 0,4 | 0,6 | 1,0 | |
| 4. | Концентрация вредных газов: Углекислого газа, % | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 |
| Аммиака, мг/м3 | ||||||
| 5. | Естественная освещенность, ед. КГО | 1,2 | 1,2 | 1,2 | 1,2 | 0,5 |
| 6. | Отношение площади остекления к площади пола | 1:10 | 1:10 | 1:10 | 1:10 | 1:20 |
| 7. | Искусственная освещенность в зоне размещения животных, люкс | 50-100 | 50-100 | 50-100 | 50-100 | 30-60 |
Справочное приложение № 3
Мероприятия по диагностике и профилактике паразитарных заболеваний.
1. Кишечные нематодозы.
Диагноз на кишечные нематодозы ставят на основании микроскопического исследования фекалий и посмертно при обнаружении взрослых гельминтов в кишечнике или их личинок (аскарид – в легких и печени, эзофагостом и трихоцефал в соскобах слизистой оболочки ободочной и слепой кишки соответственно).
Для обнаружения яиц гельминтов в фекальных массах применяют насыщенные растворы аммиачной селитры и плотностью 1,3, поваренной соли 1,2. Личинки аскарид из легочной и печеночной ткани выделяют по Берману.
Гельминтокопрологическому исследованию на кишечные нематодозы подлежат животные не моложе 2,5-3-месячного возраста в количестве не менее 10 % от имеющегося поголовья.
Эффективность дегельминтизации проверяют через 10 дней после ее проведения.
Для дегельминтизации применяют фенбендазол (в лекарственной форме 22,2 % панакура гранулята, 22 % фенкура) в дозе 0,005 г/кг массы животного в течение трех дней подряд групповым способом с кормами или в дозе 0,030 г/кг однократно, а также в дозе 0,015 г/кг в течение двух дней; мебендазол в дозе 0,0066 г/кг живой массы в течение трех дней подряд; ринтал – в дозе 0,005 г/кг однократно, ивермектин в дозе 0,0001 г/кг в течение двух дней.
Для повышения эффективности дегельминтизации наряду с антигельминтиками следует применять иммуностимуляторы (градекс в дозе 0,1 мг/кг, фумаровая кислота в дозе 0,1 г/кг).
Химиопрофилактику необходимо проводить в связи с тем, что поросята-сосуны заражаются кишечными нематодами с первых дней жизни. Раннюю химиопрофилактику проводят, применяя поросятам с 2-недельного возраста ежедневно в течение 45 дней групповым способом с кормами пиперазина адипината в дозе 0,12 г/кг. 20 %-ный тетрамизол гранулят в дозе 0,004 г/кг; фенбендазол один раз в неделю в дозе 0,001 г/кг или мебендазол в дозе 0,002 г/кг, а также ринтал в дозе 0,002 г/кг массы тела до отъема.
Высокоэффективным химиопрофилактическим действием обладает ивермектин, применяемый супоросным свиноматкам за неделю до опороса в дозе 0,0003 г/кг с кормом и через три недели после опороса в такой же дозе.
Оллуланоз.
Прижизненный диагноз ставят путем микроскопии рвотных масс больного животного, а посмертно – путем исследования соскобов со слизистой оболочки желудка в области фульдальных желез. Исследование соскобов проводят с использованием компрессория на трихинеллоскопе, трихинном микропроекторе или под микроскопом с предварительным перевариванием проб в искусственном желудочном соке по методу Ф.А. Волкова (1980) и осаждением гельминтов.
Для лечения применяют:
— ивомек в дозе 1 мл на 33 кг массы тела подкожно однократно;
— ринтал в дозе 5-10 мг/кг массы тела с кормом групповым способом однократно (по АДВ);
— пирантел в дозе 25 мг/кг массы тела с кормом групповым способом два раза в день (по АДВ);
— фенкур в дозе 15 мг/кг массы тела с кормом групповым способом однократно (по АДВ).
Смешанные паразитозы.
Для диагностики смешанных паразитозов свиней необходимо проводить комплексные исследования на гельминтозы и протозоозы. На гельминтозы (аскаридоз, эзофагостомоз, трихоцефалез, стронгилоидоз и др. нематодозы), а также на кокцидиоз диагностические исследования проводить по методу Г.А. Котельникова и В.М. Хренова (1974), на балантидиоз – методом нативного мазка и количественным методом по Н. Манжосу (1982). Гельминтокопроскопические исследования проводят на гельминтозы (аскаридоз, трихоцефалез, эзофагостомоз) через 50-60 дней после предполагаемого заражения, на стронгилятоз – через 8-10 дней, на кокцидиоз через 2-3 недели, на балантидиоз – через 1-2- недели.
Для профилактики паразитозов хряков обследуют на гельминтозы и протозоозы не реже 2 раза в год и при необходимости проводят лечебные мероприятия. В репродукторных, племенных и репродукторно-откормочных хозяйствах свиноматок обследуют на паразитозы и за месяц до опороса проводят химиотерапию с проверкой ее эффективности через 10 дней. При отсутствии возможности осуществлять преимагинальные дегельминтизации, поросят начинают обследовать и дегельминтизировать по достижении 2,5-3-месячного возраста.
Для профилактики смешанных паразитозов свиней используют антигельминтики широкого спектра действия: фенбендазол (в форме 22,2 % панакура или 22 % фенкур) в дозе 0,015 г/кг (по АДВ) два раза подряд; ринтал, мебенвет гранулят 10 %, ивермектин и др. в сочетании с фармазином в дозе 0,02 г/кг массы 2 раза в день в течение 3 дней или сочетание сульгина и сульфадимезина соответственно в дозах 0,075 г/кг и 0,04 г/кг массы в течение 4 дней; трихопол назначают поросятам весом 5-40 кг в дозе 0,25 г, свыше 40 кг – 0,5 г 2 раза в сутки в течение 3 дней; ампролиум в дозе 0,025-0,065 г/кг массы животного два раза в день три-четыре дня подряд и др.
Криптоспоридиоз.
Диагноз ставят на основании обнаружения ооцист криптоспоридий в фекалиях (методом нативного мазка и флотационные методы). Ооцисты выявляют в мазках после окрашивания из по Циль-Нильсену с докрашиванием 1%-ным бриллиантовым зеленым на 100 спирте, по Циль-Габбету, по Козлову.
Обследуют поросят с 3-4-дневного возраста, у павших поросят берут соскобы слизистой оболочки нижней части подвздошной кишки.
Для лечения криптоспоридиоза применяют перорально сульфадимезин в дозе 0,05 г/кг два раза в день и фумаровую кислоту в дозе 0,1 г/кг однократно в течение 5 дней, сульфадимезин в дозе 0,05 г/кг и ампролиум в дозе 0,2 г/кг два раза в день в течение 5 дней.
ПРИЛОЖЕНИЕ 6
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ЭПИЗООТОЛОГИЧЕСКОМУ ОБСЛЕДОВАНИЮ
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
©2015- 2020 megalektsii.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав.
Источник
Александр Александрович
Духовский, кандидат ветеринарных наук, ответственный секретарь
экспертно-консультационного совета по ветеринарии при НСС.
На промышленных свиноводческих комплексах в той или иной степени
проявляются заболевания в виде синдромов, принося огромный ущерб предприятию. В
качестве примеров можно привести респираторный синдром на доращивании или
откорме, диарейный синдром на откорме, доращивании или подсосе, аборты у
свиноматок и др. Выяснение истинной причины проявления того или иного синдрома
и ее устранение крайне важная задача, которая в первую очередь ложится на плечи
ветеринарного врача.Как правило, детально разобраться в проблеме не удается по
разным причинам: недостаток времени у специалистов для глубокого анализа, так
как, обычно, факторов выявляется несколько,
и все требуют детальной проработки;недостаток консультантов с богатым
практическим опытом, к которым можно обратиться за советом;несовершенство
лабораторной диагностики, включая недоступность некоторых методов и не на
постоянной основе использование доступных и др.В итоге, в большинстве случаев интуитивно или с
минимальной доказательной базой, выдается заключение.
По нашим наблюдениям, чаще всегочереда
технологических нарушений выращивания свиней приводит к проявлению патогенных
свойств какого-либо инфекционного агента или их сочетания, как вирусного так и
бактериального происхождения, формируя синдром. Для того чтобы разобраться в природе
того или иного синдрома, нужно по максимуму собрать всю информацию и
проанализировать. На первом этапе это могу быть статистические, клинические,
патологоанатомические данные и др. Далеенеобходимо сделать предположение и
подтвердить его или опровергнуть различными приемами. На этом этапе многие
часто и останавливаются, переходя к разноплановым практическим действиям, что
по сути своей правильно, так как необходимо оперативно реагировать на ситуацию,
только при таком подходе до выяснения истиной причины так дело и не доходит.
Синдром может уйти или сгладить свое течение, но потом снова,как правило, проявляется.
В данной статье яхотел бы поделиться опытом выяснения причины
респираторного симптомокомплекса у поросят на участке доращивания крупного
свиноводческого комплекса.
В августе-октябре 2014 года при клиническом обследовании поросят на
доращивании выявили животных с высокой температурой 40,3- 41,6°С, у большинства
животных в возрасте 50-70 дней отмечали влажный кашель, серозные истечения из
носа. Рис. 1,2. При патологоанатомическом
вскрытии у поросят данной группы были отмечены пневмонии разного
характера в 100% случаев. Рис. 3,4,5,6. При анализе статистических данных
выявили увеличение падежа в 2 раза в
данный период времени по сравнению с показателями прошлого года. Падеж вырос
преимущественно за счет увеличения данного показателя в группе поросят участка
доращивания. Рис.7.

Рис. 1 Рис.2
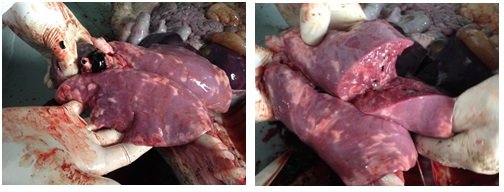
Рис. 3 Рис.
4
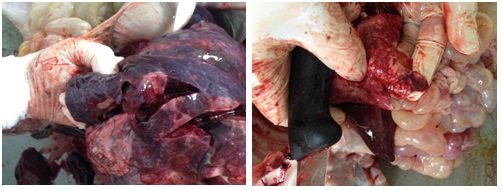
Рис. 5 Рис.
6
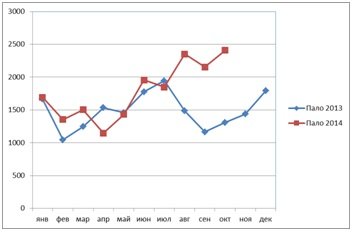
Рис. 7. Динамика падежа свиней всех групп за период 2013-2014 гг.
Изучение протоколов серологический исследований, имеющихся в хозяйстве на
момент обследования, показало циркуляцтю в стаде возбудителей следующих
заболеваний: АПП, Энзоотическая пневмония, РРСС, Гемофилезный полисерозит,
Грипп и др.
Была поставлена задача определить какой из возбудителей стал причиной
проявления столь яркой клинической и патологоанатомической картины и разработан
алгоритм действий.
Для этого был произведен диагностический убой 4-х поросят в возрасте 60
дней с характерными клиническими признаками острого респираторного заболевания
(температура 41 градус и выше, кашель и др.) и отбор материала (кровь, кусочек
легкого, бронхиальная слизь, средостенные лимфоузлы) для лабораторного исследования
методом ПЦР, ИФА и бактериологическим на все предполагаемые возбудители.
Не дожидаясь результатов лабораторных исследований, была усилена схема антибактериальной
терапии за счет ввода препаратов группы амоксициллинов, которая, в период пика
заболевания не дала быстрого ощутимого эффекта.
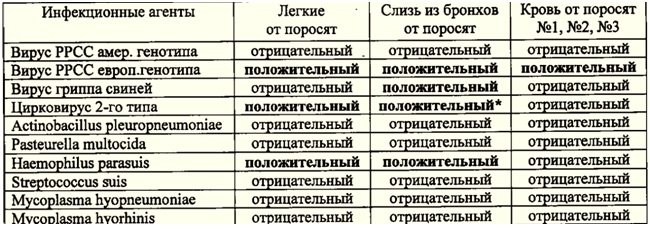
Результат исследования в ПЦР показал, что в легких, бронхиальной слизи и
пробах крови выделен европейский тип вируса РРСС. В легких и бронхиальной слизи
от поросят обнаружены цирковирус 2-го типа, вирус гриппа свиней и Haemophilusparasuis.
Табл.1.
Табл.1 Результаты исследования патматериала от вынужденно убитых поросят
методом ПЦР на наличие инфекционных агентов.
Секвенирование вируса
РРСС показало, что выявленный в легких от свиней вирус РРСС генетически
существенно отличается от всех изолятов вирусов РРСС, имеющихся в базах данных
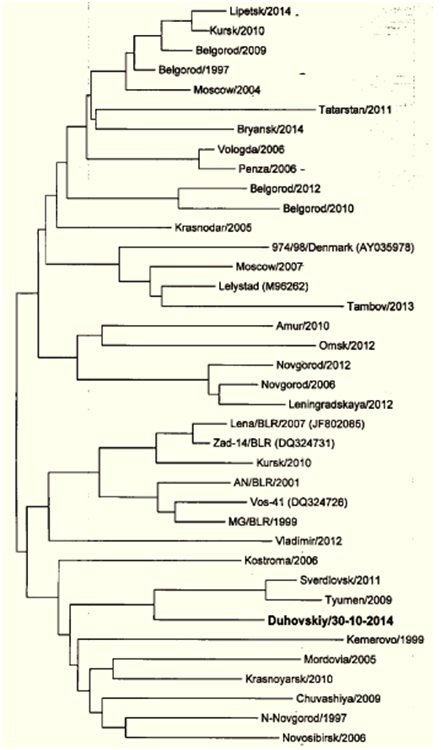
ВНИИЗЖ. Рис. 8. Было сделано предположение, что данный изолят вируса РРСС был
занесен в стадо много лет назад и, с тех пор, постоянно циркулировал в
организме животных данной популяции. В качестве специфической профилактики
вируса РРСС применялись толmко инактивированные вакцины отечественного
производства.
Рис.8 Положение изолята
«Духовский/ 30-10-2014» на филогенетическом древе вируса РРСС европейского
генотипа.
При бактериологическом исследовании из легких и бронхиальной слизи поросят был
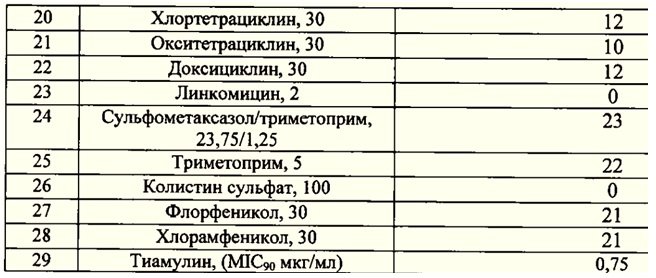
выделенвозбудитель стрептококкоза свиней Streptococcussuis. Табл.2. Изолят, выделенный из легких проявил
высокую чувствительность к группе ß-лактамных антибиотиков, а именно к
природным и полусинтетическим пенициллинам, цефалоспоринам III-IVпоколения и др.Табл.3.
Табл. 2. Результаты исследования патматериала от вынужденно убитых свиней с
респираторным синдромом бактериологическим методом на наличие инфекционных
агентов.
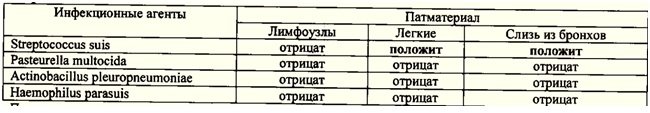
Табл.3. Результаты
определения чувствительности изолятаS. suis, выделенного из легких,к антибактериальным
препаратам.

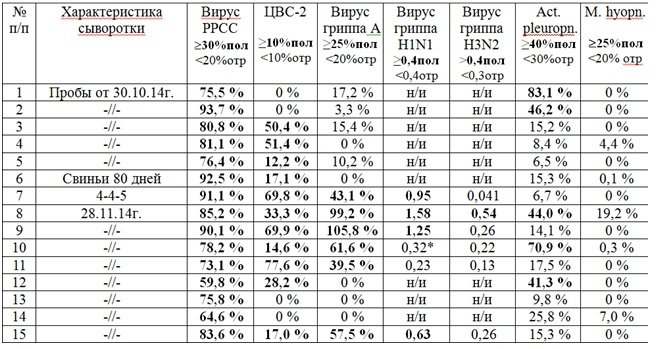
При исследовании методом ИФА сыворотки крови,
полученной от 5-и вынужденно убитых поросят в возрасте 60 дней, обнаружены
антитела к вирусу РРСС, цирковирусу 2-го типа и Actinobacilluspleuropneumoniae. Повторно, с интервалом 1 месяц, была отобрана
кровь у поросят из этой же группы для исследования на те же заболевания. В
результате сравнительного анализа было выявлено, что среднее значение антител к
вирусу РРСС практически не изменилось и составило 79,4%, против 81,5% 1 мес.
назад, к АПП произошло снижение антител с 31,9% до 26,1% соответственно. Однако
среднее значение антител к цирковирусу 2-го типа выросло с 22,8% до 32,8%
(увеличение на 44%), а к вирусу гриппа типа А увеличение произошло со средне отрицательного
значения 9,22% до средне положительного 40,67, т.е. в 4,4 раза. Необходимо
отметить, что при дополнительном исследовании положительно реагирующих
сывороток на вирус гриппа тип А было выявлено, что подтип H1N1 в большинстве случаев показывал положительную
реакцию и в более высоких значениях, чем подтипH3N2, превышая последний в 3,5 раза. Табл.4.
Табл.4. Результаты исследования сывороток свиней
методом ИФА.
Таким образом, можно сделать вывод, что проявление
ярко выраженного респираторного синдрома было обусловлено заражением поросят
вирусом гриппа и обострением течения цирковирусной инфекции. Вместе с этим
важную роль в продолжительном течении респираторного синдрома и падеже поросят
на участке доращивания сыграл вирус РРСС, так как по результатам ПЦР была
выявлена виремия и одновременно с этим высокие титры антител. Очевидно, что поросята
были заражены еще раньше и, к моменту первого взятия крови на ИФА, уже
выработали антитела в высоких титрах.
Остается не выясненным факт, почему ПЦР не выявила
стрептококк, который был культивирован бактериологическим методом, а
бактериологическим методом не обнаружен Haemophilusparasuis. На этот счет есть несколько предположений. Но в
терапевтической практике это особого значения не имеет, так как часто оба эти
возбудителя показывают высокую чувствительность к одним и тем же
антибактериальным препаратам.
Считаю, что в промышленном свиноводстве при любом
синдроме, предполагающем инфекционную природу, только комплексный всесторонний анализ поможетразобраться в ситуации и
выработать правильную стратегию для последующих действий.
Источник


