Анализ толстой капли крови на малярийный плазмодий

Малярия — одно из опаснейших паразитарных заболеваний на планете, ежегодно поражающее сотни миллионов человек. Люди должны понимать, как проводятся исследования на малярию, как распознать симптомы и когда обратиться за лечением. Ежегодно из сотен миллионов заразившихся сотни тысяч умирают, несмотря на то, что существует лекарство, заболевание поддается лечению.
Что такое малярия?
Малярия — опасное и очень заразное паразитарное заболевание, легко передающееся через укусы комаров рода анофелис и через кровь, например, при переливании. Недуг сопровождается повторяющимися приступами лихорадки, наиболее широко распространен в странах с влажным и жарким климатом. После того как паразит попал в тело, он начинает размножаться, поражает клетки, разрушает их, лавинообразно наращивая свое присутствие. Посему решившие посетить жаркие тропические страны должны проявлять повышенную осторожность, и при наименьших подозрениях сдать анализ крови. Заражению особенно подвержены:
- люди с низким иммунитетом,
- дети до 5 лет,
- беременные женщины.
Вернуться к оглавлению
Виды плазмодий
Всего различают четыре различных вида малярии и четыре типа плазмодий, ее вызывающие:
- Plasmodium falciparum, что провоцирует тропическую лихорадку — одну из самих опасных и нуждающихся в срочном лечении разновидностей заболевания.
- Plasmodium vivax — провоцирует появление трехдневной малярии.
- Plasmodium malariae — является источником четырехдневной лихорадки.
- Plasmodium ovale — главная причина малярии овале (недуга вроде трехдневной).
Вернуться к оглавлению
Симптомы малярии
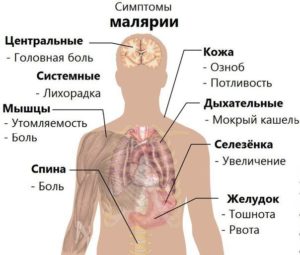 Главными (и самим очевидными) симптомами, проявляющимся при малярии, являются повторяющиеся с равными промежутками времени приступы лихорадки, повышение температуры и озноб. Длятся они несколько часов и сопровождаются такими признаками:
Главными (и самим очевидными) симптомами, проявляющимся при малярии, являются повторяющиеся с равными промежутками времени приступы лихорадки, повышение температуры и озноб. Длятся они несколько часов и сопровождаются такими признаками:
- повышение температуры до 41 °C;
- дрожь;
- проявления кашля;
- повышенная потливость (обычно сопровождает окончание приступа и снижение температуры).
Кроме того приступы могут сопровождаться такими явлениями как:
- расстройства пищеварительной системы,
- боль в разных частях тела, мышцах, голове,
- повышенная утомляемость,
- желтуха.
Хотя обычно симптомы при малярии проявляются спустя несколько недель после заражения, некоторые возбудители могут месяцами жить в организме незаметно. Во время острых приступов наблюдается тенденция к изменению состава крови, может возникать анемия, в особенности при тропической лихорадке. Возможно увеличение внутренних органов, например селезенки, но точную оценку может дать лишь врач.
Вернуться к оглавлению
Диагностические исследования малярии
 Для точного диагноза необходимо сделать общий анализ крови и мочи.
Для точного диагноза необходимо сделать общий анализ крови и мочи.
При обнаружении вышеперечисленных симптомов необходимо срочно провести диагностику малярии. Единственным основным способом диагностирования заболевания до сих пор остается непосредственное обнаружение плазмодиев в крови, которая берется у больного во время приступов. Самые распространенные способы анализа включают взятие крови на малярию методом толстой капли и мазка. Обнаружив плазмодии, можно определить, серьезно ли болен человек, каким именно штаммом. Проводятся также общее исследование крови, обследование мочи, биохимические исследования на содержание билирубина или уровень альбумина.
Вернуться к оглавлению
Общий анализ крови
Поскольку паразит влияет непосредственно на кровь, из-за лихорадки в ее составе наблюдаются различные изменения. Таким образом, показано проведение общего обследования крови для выявления малярии. Лейкоцитоз, анемия, тромбоцитопения — вот лишь немногие возможные последствия болезни.
В общий анализ входят:
- Сравнение уровня гемоглобина, а также эритроцитов — плазмодии влияют напрямую на кровяные тельца, разрушая их во время болезни.
- Оценка показания уменьшения тромбоцитов — наблюдается у подавляющего большинства больных, является одним их характерных признаков малярии.
- Проверка лимфоцитов — их уровень тоже может меняться во время болезни.
Вернуться к оглавлению
Другие анализы
 Толстая капля на малярию – простой метод обнаружения заболевания.
Толстая капля на малярию – простой метод обнаружения заболевания.
Можно также выделить ряд других анализов крови, что могут обнаружить малярию:
- Метод выявления антител к малярии — позволяет с помощью введения в организм плазмодия отслеживать реакцию иммунитета на него. Если итогом будет негативная реакция, это позволит исключить диагноз.
- Метод выявления белков плазмодия является одним из новейших возможных анализов, позволяющих определять составные молекулы возбудителя. При сравнительной быстроте способ обладает неплохой точностью, а также небольшими финансовыми затратами для пациента.
- Метод ПЦР, или полимеразная цепная реакция — непосредственно определяет генетический материал малярийного плазмодия. Проводя такой анализ крови можно определить точное число возбудителей, даже если оно небольшое. К сожалению, одним из недостатков является высокая стоимость процедуры.
Вернуться к оглавлению
Анализ толстой капли крови и мазка
Анализ мазка и толстой капли крови являются наиболее дешевыми и простыми методами обнаружения малярии. В то же время они требуют внимательности и значительных трудозатрат, а также исполнения ряда рекомендаций. При необходимости обследовать более одного пациента необходимо подготовить инструментарий заранее. При тонком мазке кровь берут из безымянного либо среднего пальца на левой руке. При изготовлении мазка палец удерживается ранкой кверху. Мазок крови — небольшой, его располагают в центре стекла.
Толстая капля отличается от мазка возможностью исследовать больший объем материала. Если обычные мазки крови— тоненькие, то капля, наносимая на стекло этим методом, имеет размер с монету. В итоге, исследуется в десятки раз больший объем крови. В дальнейшем каплю подсушивают, и после окрашивания краской Романовского, промывания — исследуют. Лучше, если анализы будет проводить опытный исследователь, ведь неподготовленный может принять за паразитов различные загрязнения или образования: бляшки Биццоцеро, обломки лейкоцитов, различные микроорганизмы, включая грибок или простейших, случайно попавших на образец.
Источник
Диагностика малярии основана на данных клинических проявлений, эпидемиологического расследования и лабораторных методах исследования, включающих методики выявления паразитов, их количества, видовую принадлежность и обнаружение антител в организме исследуемого. Обследованию в первую очередь подлежат пациенты из группы риска — прибывшие из эндемичных по малярии регионов, лихорадка у которых появилась в первые два года после выезда из этих регионов.
Рис. 1. Забор крови для приготовления препарата «толстая капля».
Рис. 2. Окраска и вид препаратов «толстая капля» и тонкий мазок.
Диагностика малярии с использованием микроскопического метода
Микроскопия препарата «толстая капля» и тонкого мазка, позволяющая обнаружить паразитов, их количество и видовую принадлежность, является ведущим методом диагностики малярии. Она проводится при малейшем подозрении на это заболевание, независимо от температурной реакции пациента. Для определения видовой принадлежности паразитов и стадии заболевания используется тонкий мазок крови. В толстой капле локализуется больше паразитов, чем в мазке. Этот метод диагностики превосходит методику определения наличия возбудителей малярии в тонком мазке крови в 20 — 40 раз.
В периферической крови паразиты обнаруживаются через определенное время после заражения:
- при 3-х дневной малярии — через 8 — 12 дней,
- при тропической — от пяти с половиной дней до 12,
- при 4-х дневной — через 15 — 21 день,
- при малярии, подобной 3-х дневной — через 9 — 15 дней.
Паразиты в крови присутствуют как во время лихорадочного приступа, так и в межприступный период и при паразитоносительстве.
Рис. 3. Техника приготовления тонкого мазка.
Техника приготовления «толстой» капли
Полученная при проколе пальца капля крови наносится на предварительно очищенное и сухое предметное стекло и размазывается до получения пятна 1 см в диаметре. После подсушивания на воздухе предметное стекло заливается краской Романовского—Гимзы. По истечении 40-минутной экспозиции препарат ополаскивается под проточной водой и подсушивается при комнатной температуре, установленный в вертикальное положение.
Под микроскопом исследуется не менее 100 полей зрения. Более эффективным считается исследование 2-х толстых капель в течение 2,5 минут, чем 1-й капли в течение 5-и минут. 100 полей зрения просматриваются даже в том случае, когда малярийные плазмодии выявились уже в первых полях. Это производится для того, чтобы не пропустить микст-инфекцию.
Рис. 4. Микроскопия препарата «толстая капля» и тонкого мазка является ведущим методом диагностики малярии.
Порог обнаружения паразитов
Порогом обнаружения малярийных плазмодиев называется минимальная концентрация возбудителей, которую возможно выявить при микроскопировании препарата «толстая капля». При заболевании этот показатель составляет 5 паразитов в одном микролитре крови. При просмотре 100 полей зрения обследуется 0,2 мкл крови.
При наличии косвенных признаков малярии (пребывание в эндемичных зонах, гипохромная анемия, обнаружение пигмента в моноцитах) и отрицательных результатов исследования препаратов «толстая капля», исследование вновь повторяется более тщательно, и не одно, а серия, состоящая из 4 — 6 препаратов при одном уколе, либо полученных при заборе крови, который производится 4 — 6 раз в сутки в течение 2 — 3 дней.
Интенсивность паразитемии определяется знаком «+».
- 1 (+) обозначает выявление от 1 до 100 паразитов в 10 п/зр, что соответствует 5 — 50 плазмодиям в одном мкл крови;
- 2 (+) обозначает выявление от 10 до 100 паразитов в 10 п/зр, что соответствует 50 — 500 плазмодиям в одном мкл крови;
- 3 (+) обозначает выявление от 1 до 10 паразитов в 1 п/зр, что соответствует 500 — 5000 плазмодиям в одном мкл крови;
- 4 (+) обозначает выявление от 10 до 100 паразитов в 1 п/зр, что соответствует 5000 — 50000 плазмодиям в одном мкл крови;
- 5 (+) обозначает выявление более 100 паразитов в 1 п/зр, что соответствует более 50000 плазмодиям в одном мкл крови.
Интенсивность паразитемии можно вычислить по количеству паразитов на 100 эритроцитов в 10 полях зрения, либо по соотношению числа паразитов и лейкоцитов в 1 мкл крови.
По интенсивности паразитемии определяется прогноз при тропической малярии. При других видах заболевания более 2% эритроцитов не поражается.
Формы малярийных плазмодиев в разные фазы развития
В препарате крови «толстая капля» возможно определить плазмодии малярии, находящиеся на разных стадиях развития — трофозоида, кольца, шизонта, морулы, и гаметы.
Рис. 5. Plasmodium ovale имеет округлую форму.
Рис. 6. Молодой трофозоит Plasmodium vivax в эритроците.
Рис. 7. Юные трофозоиды Plasmodium falciparum.
Рис. 8. Кольцевидные трофозоиты Plasmodium vivax.
Рис. 9. Амебовидные шизонты Plasmodium vivax.
Рис. 10. Зрелые шизонты Plasmodium vivax.
Рис. 11. Женские гаметоциты возбудителей тропической малярии.
Рис. 12. Гаметоциты плазмодий тропической малярии имеют полулунную форму, плазмодии других видов заболевания — округлую.
Рис. 13. В процессе роста в цитоплазме паразитов накапливается пигмент. На фото Р. vivax.
Контроль эффективности лечения
При адекватном лечении малярии уровень паразитемии в течение суток снижается на 25% и более, а через 3 суток от начала лечения он должен составлять не более 25% от исходного. В случае обнаружения паразитов на 4-е сутки от начала лечения свидетельствует о развитии лекарственной резистентности возбудителей.
Кратность проведения исследования
При выявлении малярии микроскопическое исследование препаратов крови проводится ежедневно. При тяжелой форме тропической малярии микроскопия проводится 2 раза в день до исчезновения возбудителей в крови и далее еженедельно до 28 дня лечения с целью оценки его эффективности и выявления резистентности к противомалярийным препаратам.
Рис. 14. Эритроциты при инфицировании P. vivax и P. ovale увеличиваются, обесцвечиваются и деформируются, в них появляется токсическая зернистость.
При инфицировании P. malariae и P. falciparum форма и размеры эритроцитов не изменяется. На фото деформированные эритроциты больного малярией (микрофотография в сканирующем микроскопе).
к содержанию ↑
Иммунологические методы диагностики малярии
С помощью серодиагностики малярии возможно выявить в сыворотке крови пациента антитела и растворимые паразитарные антигены. Серологические реакции показаны к применению в случаях появления у больных лихорадки неясного генеза, гепатоспланомегалии, анемии, а также для исследования крови донора — предполагаемого источника инфекции. Серологические реакции применяются при эпидемиологическом наблюдении за лицами, проживающими в неблагополучных по малярии в прошлом территориях.
Чаще всего при диагностике малярии применяется НРИФ — непрямая реакция иммунофлуоресценции. Используются так же ИФА, РИГА и др. Внедряется в практику использование реакции энзим-меченых антител (РЭМА).
В случаях очень низкой паразитемии показано применение ПЦР (полимеразной цепной реакции). Дороговизна и сложность применения данной методики не позволяет широко ее использовать.
Разработаны новые методы диагностики малярии — экспрессного микроскопического анализа препаратов крови с использованием флюоресцирующих красителей, позволяющие в течение двух минут выявить паразитов тропической малярии, количество которых более 60 в 1 мкл гемолизированой крови.
При малярии антитела появляются на 8 — 27 день паразитемии. Первыми появляются антитела IgM, затем — антитела IgG. Антитела после перенесенной малярии и успешного излечения могут длительно сохраняться в крови человека — от 0,5 до 2 и даже 20 лет.
Рис. 15. Чаще всего при диагностике малярии применяется НРИФ — непрямая реакция иммунофлуоресценции.
к содержанию ↑
Дифференциальная диагностика малярии
Малярию следует отличать от гриппа и других ОРВИ, кишечных инфекций, лептоспироза, желтой лихорадки, злокачественных форм вирусных гепатитов, тифо-паратифозных заболеваний, сепсиса, бруцеллеза, сепсиса, геморрагических лихорадок, заболеваний крови.
При коматозном состоянии малярию следует отличать от эпидемического цереброспинального менингита, уремической, печеночной и диабетической комы.
Иногда малярию следует дифференцировать с холециститом, холангитом, абсцессом печени, пиелонефритом и лимфогранулематозом.
Рис. 16. Рутинное исследование препарата «толстая капля» в регионах эндемичных по малярии.
Статьи раздела «Малярия»
Самое популярное
ПОНРАВИЛАСЬ СТАТЬЯ?
Подпишитесь на нашу рассылку!
Источник
ЦЕЛЬ: диагностическая, обнаружение малярийных плазмодиев в крови
ОСНАЩЕНИЕ:
1. 70% раствор спирта этилового и эфир медицинский.
2. Предметные стёкла, обезжиренные смесью Никифорова.
3. Бланки направлений, авторучка.
4. Стеклограф.
5. Спички.
6. Круглая резинка.
7. Конверт из крафт-бумаги.
8. Лоток для сброса.
9. Ёмкость с дезинфицирующим раствором.
10. Стерильные: лоток, индивидуальные перья-копья, пинцет, ватные шарики.
ПОДГОТОВКА ПАЦИЕНТА И МЕДИЦИНСКОГО РАБОТНИКА:
1. Установить доверительные отношения с пациентом.
2. Объяснить пациенту цель и ход процедуры, получить его согласие.
ТЕХНИКА ВЫПОЛНЕНИЯ:
1. Вымыть и осушить руки.
2. Надеть перчатки и маску.
3. Обработать кожу IV пальца руки пациента спиртом с эфиром.
4. Вскрыть перо – копье, проверив срок годности.
5. Проколоть мякоть латеральной фаланги IV пальца индивидуальным пером-копьём.
6. Поместить перо в лоток для сброса.
7. Снять первую каплю крови сухим ватным шариком.
8. Поместить шарик в ёмкость с дезинфицирующим раствором.
9. Повернуть палец проколом вниз.
10. Прикоснуться предметным стеклом ко второй капле крови в двух местах (при необходимости взять 2 — 3 стекла).
11. Приложить ватный шарик со спиртом к месту прокола.
12. Размазать каплю крови на предметном стекле в диск диаметром 10-15 мм углом второго предметного стекла.
13. Обвести толстую каплю крови стеклографом с обратной стороны стекла.
14. Указать регистрационный номер с обратной стороны стекла.
15. Высушить препарат на воздухе в горизонтальном положении, предохраняя от пыли и мух.
16. Поместить стекло с толстой каплей между двумя предметными стёклами, используя спички и круглую резинку.
17. Поместить препарат в конверт.
ЗАВЕРШЕНИЕ:
1. Оформить направление в паразитологическую лабораторию.
2. Отправить конверт в лабораторию сразу же.
3. Провести дезинфекцию использованного инструментария и оснащения:
· Перо- копьё замочить в 5% растворе хлорамина на 60 минут, затем утилизировать.
· Тампон и марлевую салфетку замочить в 5% растворе хлорамина на 60 минут, а затем утилизировать.
· Лоток обработать двукратным протиранием 3% хлорамином с интервалом 15 минут или погрузить в раствор на 1 час.
· Снять перчатки, опустить в 5% раствор хлорамина на 1 час, затем утилизировать.
4. Снять маску.
5. Вымыть и осушить руки.
ИНСТРУКЦИЯ ПО ЗАБОРУ МАТЕРИАЛА
ПРИ ПОДОЗРЕНИИ НА ЗАБОЛЕВАНИЕ ХОЛЕРОЙ.
ПОМНИ! Испражнения и рвотные массы для лабораторного исследования нужно брать немедленно при выявлении больного и обязательно до начала лечения. Вся посуда для проведения забора материала должна быть стерильной, проверена на целостность и подписана до начала забора материала.
ОСНАЩЕНИЕ:
1. Защитный костюм 4-го типа.
2. Стерильная банка с плотной крышкой.
3. Стерильная ложка или шпатель.
4. Емкости для дезинфицирующих растворов и ветошь.
5. Направление, ручка.
6. Целлофановые пакеты и крафт-бумага.
7. Контейнер или бикс для транспортировки.
8. Спирт 70%
9. Резиновое кольцо или шпагат.
10. Лейкопластырь или липкая лента.
ПОДГОТОВКА МЕДИЦИНСКОГО РАБОТНИКА:
1. Приготовить необходимое оснащение.
2. Заполнить направление, завернуть его в целлофановый пакет и положить в бикс.
3. Промаркировать емкости: «1% хлорамин», «3% хлорамин».
4. Надеть защитный костюм 4 типа (длинный медицинский халат, перчатки, шапочку, клеенчатый фартук, маску).
5. Развести хлорамин в 2-х ёмкостях: 3% и 1%.
ТЕХНИКА ВЫПОЛНЕНИЯ:
ПОМНИ! Материал для исследования на холеру берется только из судна или других ёмкостей для сбора испражнений.
1. Взять стерильные ёмкости (баночки) для сбора испражнений с плотными крышками, промаркировать их.
2. Набрать из судна (лотка, таза) испражнения или рвотные массы стерильным шпателем или ложкой до 50 мл.
3. Положить шпатель (ложку) в ёмкость с 3% раствором хлорамина.
4. Наружную поверхность ёмкости (баночки) протиреть ветошью, смоченной в 1% хлорамине.
5. Плотно закрыть крышкой, обернуть крышку крафт-бумагой или поместить в целлофановый пакет, закрепив резиновым кольцом.
6. Поместить емкости с материалом в контейнер или бикс.
7. Обработать руки в перчатках 1% раствором хлорамина.
8. Закрыть контейнер (бикс), обработать 1% раствором хлорамина и заклеить лейкопластырем или липкой лентой.
9. Обработать руки в перчатках 1% раствором хлорамина.
10. Промаркировать контейнер: «ВЕРХ», «НЕ ОТКРЫВАТЬ!».
ЗАВЕРШЕНИЕ:
1. Бикс отправить в бактериологическую лабораторию ЦГСЭН под роспись (3 этаж) с медицинским работником, прошедшим инструктаж. Во время транспортировки бикс не открывать, не болтать и не переворачивать. После доставки материала контейнер (бикс) обрабатывается и доставляется в отделение.
2. Провести дезинфекцию испражнений пациента: засыпать сухой хлорной известью 1: 5, экспозиция 1 час.
3. Провести обработку фартука 3% хлорамином.
4. Снять загрязненные перчатки и погрузить их в 5% хлорамин на 1 час, затем утилизировать.
5. Обработать руки 70% спиртом, надеть стерильные перчатки и начать оральную регидратацию.
6. После ее проведения провести обработку инструментария и рабочего места.
Источник