Анализ крови сывороточный амилоид а
Белок амилоида А сывороточный (SAA-1), кат. номер HK333-01
Набор реагентов для количественного определения сывороточного белка амилоида A (SAA-1) методом иммуноферментного анализа
Кат. номер: HK333-01
Поставщик: Hycult biotech
Упаковка: 96 тестов
Доставка: 60 дней
Цена:
по запросу
Назначение: набор предназначен для количественного определения человеческого сывороточного белка амилоида A (SAA-1) в образцах сыворотки, плазмы, мочи методом иммуноферментного анализа.
Диапазон измерения: 3.1-200 нг/мл.
Чувствительность: 3.1 нг/мл.
Приложения теста: сывороточный амилоид A (SAA) – это циркулирующий предшественник белка амилоида A. У человека описаны четыре гена SAA. Два гена (SAA1 и SAA2) кодируют острофазовый SAA (A-SAA). SAA3 – это псевдоген, для которого не найдено мРНК и белкового продукта. SAA4 кодирует конститутивный SAA (C-SAA).
М. м. SAA 20 кДа, и 12.5 кДа в денатурированном состоянии. Основным местом синтеза SAA является печень. Внепеченочная продукция показана в макрофагах, эндотелиальных клетках, эпителиальных клетках, атеросклеротических поражениях, опухолях и синовиальной ткани. SAA-1 является основной изоформой SAA в плазме. SAA обладает многими иммуномодуляторными свойствами, он может индуцировать хемотаксис и экспрессию молекул адгезии, обладает цитокин-подобными свойствами и может способствовать усилению экспрессии металлопротеиназ. Он усиливает связывание липопротеинов с макрофагами и, таким образом, помогает доставлять липиды к местам повреждений для восстановления ткани. Кроме того, SAA участвует в транспорте и метаболизме холестерина.
SAA — это острофазовый белок, и его уровень повышен при многих воспалительных заболеваниях. Наиболее известным маркером воспаления является C-реактивный белок (CRP). Однако SAA повышается ранее и резче, чем CRP. В отличие от CRP, SAA ведет себя одинаково и при вирусной, и при бактериальной инфекции. Уровень SAA повышается очень сильно при остром воспалении и может достигать значений в 1000 раз превышающих нормальный уровень.
Более того, SAA является ранним маркером отторжения трансплантата, возможным маркером активности опухоли и клинически значимым маркером бактериальной и вирусной инфекции. Повышенный уровень SAA в течение длительного времени предрасполагает к вторичному амилоидозу, внеклеточному накоплению амилоидных фибрилл, происходящих из циркулирующего предшественника, в различных тканях и органах. Наиболее частая форма амилоидоза встречается вторично при хроническом воспалительном заболевании, особенно при ревматоидном артрите. Данный метод SAA ELISA может быть использован для количественного определения SAA-1, основной изоформы SAA в плазме. Уровень SAA-1 в сыворотке/плазме здоровых людей лежит в диапазоне 1-5 мкг/мл.
Поддержка
Наш телефон: + 7 (495) 647-27-40
Мы собираем cookie, чтобы сделать использование сайта комфортным для Вас, анализировать трафик сайта, персонализировать контент и рекламу.
Продолжая пользоваться сайтом, Вы соглашаетесь на использование нами файлов cookie и других данных в соответствии с Положением о конфиденциальности.
Соглашаюсь
Источник
Содержание
сывороточного белка амилоида А у взрослых
в норме составляет менее
0,4 мг/л.
Сывороточный
белок амилоида А (САА) является нормальным
белком сыворотки (служит
предшественником фибриллярного тканевого
белка АА), синтезируемым в печени. САА
является
быстро и сильно реагирующим маркером
острой фазы.
Усиленный
синтез САА гепатоцитами при воспалительных
заболеваниях стимулируется макрофагальным
медиатором — интерлейкином 1, что
приводит к резкому увеличению содержания
САА в крови (на два три порядка по
сравнению с нормой). Если воспалительный
процесс
завершается, повышенные количества САА
разрушаются макрофагами. Однако в случае
длительно существующего воспалительного
процесса, макрофаги не в состоянии
осуществить полную деградацию САА,
и из его фрагментов в инвагинатах
плазматической мембраны амилоидобласта
(макрофаги, плазматические и миеломные
клетки, фибробласты, эн-дотелиоциты
и др.) происходит сборка фибрилл амилоида.
Амилоид представляет собой гли-копротеид,
основным компонентом которого являются
фибриллярные белки. Выделяют четыре
группы этих белков, характерных для
определенных форм амилоидоза: 1) АА-белок
(неассоциированный
с иммуноглобулинами), образующийся из
своего аналога белка САА; 2)
AL-белок
(ассоциированный с иммуноглобулинами),
предшественником его являются L-цепи
иммуноглобулинов; 3) AF-белок,
в образовании которого участвует главным
образом преальбумин; 4) АБСрбелок,
предшественник которого преальбумин.
Соответственно специфическим
белкам амилоида выделяют АА-, AL-,
AF-
и ASC,-амилоидоз.
Амилоидоз — диспротеиноз,
сопровождающийся глубоким нарушением
белкового обмена, появлением аномального
фибриллярного белка в межуточной ткани
и стенках сосудов сложного вещества
— амилоида.
Высокая
концентрация САА в сыворотке крови
является маркером АА-амилоидоза, который
может быть первичным (периодическая
болезнь, болезнь Маккла и Уэлса) и
вторичным.
Вторичный амилоидоз развивается как
осложнение ряда заболеваний: хронических
инфекций (особенно туберкулеза),
болезней, характеризующихся
гнойно-деструктивными процессами
(хронические неспецифические заболевания
легких, остеомиелит), злокачественных
заболеваний (парапротеинемии,
лимфогранулематоз, рак), ревматических
болезней (особенно ревматоидного
артрита).
При
воспалительных процессах концентрация
САА в сыворотке крови может увеличиваться
очень значительно, особенно когда
сопутствует вторичный амилоидоз.
Концентрация
САА в сыворотке крови повышается уже
через несколько часов после инсульта,
реагируя аналогично С-реактивному
белку, но в большей степени [Тиц Н., 1997].
Гаптоглобин в сыворотке
Гаптоглобин
(Нр) — гликопротеин плазмы крови,
специфически связывающий гемоглобин.
Содержание его в различных возрастных
группах колеблется в достаточно широких
пределах.
Различают три наследственных фенотипа
гаптоглобина: Нр 1 — 1, Нр 2—1, Нр 2—2.
Первая
форма его в различных группах колеблется
в достаточно широких пределах (табл
4.4) представляет собой мономер с
молекулярной массой 85 000, две другие —
полимеры с варьирующей,
но гораздо большей массой. Гаптоглобин
1 — 1 состоит из 4 полипептидных цепей:
2
легких — альфа-цепи и 2 тяжелых —
бета-цепи, соединенных между собой
дисульфидны-ми мостиками.
Таблица4.4.
Содержание гаптоглобина в сыворотке в
норме
[Тиц Н., 1997]
Возраст | Концентрация, |
Новорожденные 6 мес — 16 | 50-480 |
124
 Основной
Основной
физиологической функцией гаптоглобина
является сохранение железа в организме,
кроме того, комплекс гемоглобин-гаптоглобин
обладает высокой пероксидазной
активностью,
оказывая тормозящий эффект на процессы
перекисного окисления липидов.
Гаптоглобин
относится к белкам острой фазы. Повышение
его уровня в крови происходит
вследствие стимуляции интерлейкинами
клеток печени. Однако изменения уровня
гаптоглобина в крови не столь
закономерны, как других острофазовых
белков. Это обусловлено тем,
что при наличии гемолиза in
vivo,
что довольно часто сопровождает
острофазовые процессы,
гаптоглобин селективно связывается со
свободным гемоглобином плазмы, что
приводит к снижению его в крови.
Поэтому суммарным результатом может
быть повышение, снижение или сохранение
нормального уровня белка. Для исключения
влияния гемолиза на результаты
определения гаптоглобина их необходимо
анализировать в сопоставлении с данными
хотя бы еще одного реактанта острой
фазы. Основные заболевания и состояния,
приводящие к повышению уровня
гаптоглобина в сыворотке крови, аналогичны
приведенным для орозомукоида. Кроме
того, повышение гаптоглобина в крови
отмечается при холестазе, лечении
кортикостероидами
Снижение
уровня гаптоглобина выявляется при
всех видах гемолиза in
vivo
— аутоиммунном,
изоиммунном (при переливании крови, для
диагностики необходимо провести
исследование до и после переливания),
механическом (искусственные клапаны
сердца, бактериальный
эндокардит, травмы); при острых и
хронических заболеваниях печени; может
встречаться при неэффективном эритропоэзе
(дефицит фолиевой кислоты, гемоглобинопатии);
дефектах мембраны эритроцитов или
метаболизма (дефицит
глюкозо-6-фосфатдегид-рогеназы);
увеличении селезенки.
При
нефротическом синдроме изменение уровня
гаптоглобина в крови зависит от
генетического
фенотипа гаптоглобина у пациента. При
Нр 1 — 1, молекулярная масса которого
относительно
невелика, уровень гаптоглобина снижается
вследствие потери его с мочой. При
других типах (с более высокой молекулярной
массой) потери с мочой не происходит и
гаптоглобин
накапливается в крови.
Содержание
гаптоглобина в сыворотке крови повышается
при злокачественных новообразованиях
некоторых локализаций (рак молочной
железы, желудочно-кишечного тракта,
гениталий,
легкого и др.). Обнаруживаются также
изменения представительства типов
гаптоглобина
в сыворотке крови больных раком гениталий
и молочной железы, заключающиеся в
преобладании Нр 1 —1 при злокачественных
опухолях молочной железы и в достоверном
снижении
содержания Нр 2—2 при раке шейки матки.
Церулоплазмин
(медьсодержащая оксидаза) в сыворотке
Содержание церулоплазмина в сыворотке
в норме у взрослых 300—580 мг/л.
Церулоплазмин
представляет собой белок с молекулярной
массой около 150000 даль-тон,
содержит 8 ионов Си+
и 8 ионов Си2+.
Главный медьсодержащий белок плазмы
относится
к альфа-2-глобулинам; на его долю приходится
3 % общего содержания меди в организме
и свыше 95 % меди сыворотки. Церулоплазмин
обладает выраженной оксидазной
активностью; в плазме он также ограничивает
освобождение запасов железа, активирует
окисление
аскорбиновой кислоты, норадреналина,
серотонина и сульфгидрильных соединений,
а также инактивирует активные формы
кислорода, предотвращая перекисное
окисление
липидов.
Недостаточность
церулоплазмина вследствие нарушения
его синтеза в печени вызывает болезнь
Вильсона—Коновалова (гепатоцеребральная
дегенерация). При недостаточности
церулоплазмина
ионы меди выходят во внесосудистое
пространство (содержание меди в крови
также
снижается). Они проходят через базальные
мембраны почек в гломерулярный фильтрат
и выводятся с мочой или накапливаются
в соединительной ткани (например, в
роговице).
Для проявления признаков заболевания
особое значение имеет степень накопления
меди
в ЦНС. Недостаточность ионов меди в
крови (вследствие дефицита церулоплазмина)
приводит к повышению их резорбции в
кишечнике, что еще больше способствует
ее накоплению
в организме с последующим воздействием
на ряд жизненно важных процессов. Низкие
уровни церулоплазмина в сыворотке крови
отмечаются также при нефротическом
синдроме,
заболеваниях желудочно-кишечного
тракта, тяжелых заболеваниях печени
вследствие его
потерь и нарушения синтеза.
Церулоплазмин
является белком острой фазы (период
полураспада 6 сут), поэтому возрастание
его уровня наблюдается у больных с
острыми и хроническими инфекционными
за-
125
болеваниями,
циррозом печени, гепатитами, инфарктом
миокарда, системными заболеваниями,
лимфогранулематозом. Повышение уровня
церулоплазмина отмечается у больных
шизофренией.
Содержание
церулоплазмина в сыворотке крови
увеличивается при злокачественных
новообразованиях различной локализации
(рак легкого, молочной железы, шейки
матки, желудочно-кишечного
тракта) в 1,5—2 раза, достигая более
значительных величин при распространенности
процесса. Успешное химио- и лучевое
лечение сопровождается снижением уровня
цеулоплазмина вплоть до нормального
уровня. При неэффективности комбинированной
терапии, а также при прогрессировании
заболевания содержание церулоплазмина
остается
высоким.
Соседние файлы в предмете Введение в специальность
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Белок амилоида А сывороточный (SAA-1), кат. номер HK333-01
Набор реагентов для количественного определения сывороточного белка амилоида A (SAA-1) методом иммуноферментного анализа

Кат. номер: HK333-01
Поставщик: Hycult biotech
Упаковка: 96 тестов
Доставка: 60 дней
Цена:
по запросу
Назначение: набор предназначен для количественного определения человеческого сывороточного белка амилоида A (SAA-1) в образцах сыворотки, плазмы, мочи методом иммуноферментного анализа.
Диапазон измерения: 3.1-200 нг/мл.
Чувствительность: 3.1 нг/мл.
Приложения теста: сывороточный амилоид A (SAA) – это циркулирующий предшественник белка амилоида A. У человека описаны четыре гена SAA. Два гена (SAA1 и SAA2) кодируют острофазовый SAA (A-SAA). SAA3 – это псевдоген, для которого не найдено мРНК и белкового продукта. SAA4 кодирует конститутивный SAA (C-SAA).
М. м. SAA 20 кДа, и 12.5 кДа в денатурированном состоянии. Основным местом синтеза SAA является печень. Внепеченочная продукция показана в макрофагах, эндотелиальных клетках, эпителиальных клетках, атеросклеротических поражениях, опухолях и синовиальной ткани. SAA-1 является основной изоформой SAA в плазме. SAA обладает многими иммуномодуляторными свойствами, он может индуцировать хемотаксис и экспрессию молекул адгезии, обладает цитокин-подобными свойствами и может способствовать усилению экспрессии металлопротеиназ. Он усиливает связывание липопротеинов с макрофагами и, таким образом, помогает доставлять липиды к местам повреждений для восстановления ткани. Кроме того, SAA участвует в транспорте и метаболизме холестерина.
SAA — это острофазовый белок, и его уровень повышен при многих воспалительных заболеваниях. Наиболее известным маркером воспаления является C-реактивный белок (CRP). Однако SAA повышается ранее и резче, чем CRP. В отличие от CRP, SAA ведет себя одинаково и при вирусной, и при бактериальной инфекции. Уровень SAA повышается очень сильно при остром воспалении и может достигать значений в 1000 раз превышающих нормальный уровень.
Более того, SAA является ранним маркером отторжения трансплантата, возможным маркером активности опухоли и клинически значимым маркером бактериальной и вирусной инфекции. Повышенный уровень SAA в течение длительного времени предрасполагает к вторичному амилоидозу, внеклеточному накоплению амилоидных фибрилл, происходящих из циркулирующего предшественника, в различных тканях и органах. Наиболее частая форма амилоидоза встречается вторично при хроническом воспалительном заболевании, особенно при ревматоидном артрите. Данный метод SAA ELISA может быть использован для количественного определения SAA-1, основной изоформы SAA в плазме. Уровень SAA-1 в сыворотке/плазме здоровых людей лежит в диапазоне 1-5 мкг/мл.
Поддержка
Наш телефон: + 7 (495) 647-27-40
Мы собираем cookie, чтобы сделать использование сайта комфортным для Вас, анализировать трафик сайта, персонализировать контент и рекламу.
Продолжая пользоваться сайтом, Вы соглашаетесь на использование нами файлов cookie и других данных в соответствии с Положением о конфиденциальности.
Соглашаюсь
Источник
Это очень личная история. Я расскажу о том, как пятнадцать лет назад мы с коллегами обнаружили подозреваемого (белок альфа-амилоид) в преступлении (соучастии в патогенезе рака). После нескольких лет работы с ним мы решили, что это просто свидетель (участник воспалительного каскада, не связанного с развитием рака) и отпустили его (прекратили проект). Я же никогда не верил в его невиновность. Маленькие зацепки у меня были, но… Только недавно с помощью отрядов спецназа, вездеходов, вертолетов и приборов ночного видения (статья в Nature, больше десятка линий трансгенных мышей, опухолевые трансплантаты и клинические образцы) другие следователи доказали вину подозреваемого в одном эпизоде преступления (метастазировании рака поджелудочной железы в печень).
В самом начале века молодым «постдоком» я оказался в первой в стране лаборатории протеомики . Мне поручили работать на своеобразном приборе: масс-спектрометре SELDI (surface-enhanced laser desorption/ionisation — усиленная поверхностью лазерная десорбция-ионизация). По сути, это был небольшой времяпролетный детектор, очень примитивный по нынешним временам. Лазерную ионизацию содержимого образца проводили на особых чипах, которые, помимо своих обычных свойств, содержали ковалентно привязанный хроматографический носитель. Разными способами образец можно было очищать и фракционировать на чипе, после чего те вещества, что на нем остались, анализировали в масс-спектрометре. Создатели прибора SELDI рекламировали его как будущее устройство для клиники. И действительно, он был очень простым в обращении и хорошо подходил для получения масс-спектров сложных биологических образцов — например, плазмы крови и других жидкостей человеческого организма.
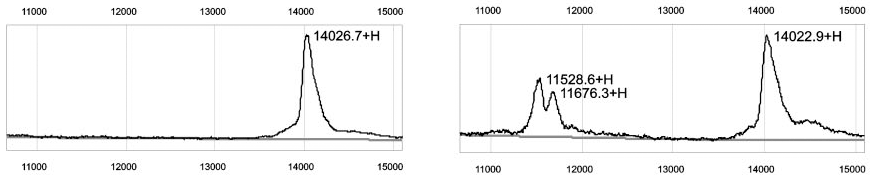
После того, как я немного освоил прибор, было решено сравнить с его помощью несколько образцов плазмы крови от пациенток с раком яичника с образцами от здоровых женщин. Профили оказались очень похожими, ведь прибор регистрировал в масс-спектре всего несколько десятков пиков. Но в некоторых спектрах крови больных в области молекулярных масс 11–12 кДа прямо-таки торчали два внушительных пика (рис. 1).

Рисунок 1. Пики сывороточного амилоида А на масс-спектре SELDI-TOF плазмы крови пациентки с раком яичника (справа) и их отсутствие у здоровой женщины (слева). По вертикальной оси — интенсивность сигнала; по горизонтальной — отношение молекулярной массы к заряду (m/z), Да.
Нам с коллегами не без труда удалось установить природу этих пиков, для чего потребовалось применить несколько косвенных методов. Пики были образованы разными изоформами белка сывороточного амилоида А (SAA) . Протеомное исследование SAA при раке яичника захватило меня на несколько последующих лет, в результате чего было опубликовано несколько статей [2], [3]. Амилоид А — хорошо известный белок острой фазы , и повышение его уровня при разных опухолях было известно давно, еще до развития протеомики (см. врезку). Это значительно остудило наш энтузиазм в плане его клинического значения. Тем более что для скрининга он бы вряд ли пригодился в связи с тем, что проявлялся далеко не у всех пациенток . Звучали мнения, что мы в очередной раз при помощи дорогой техники изобрели велосипед. Рак, мол, это совершенно отдельный процесс, просто он сопровождается воспалением, а в ответ выбрасываются белки острой фазы, о чем знали с середины двадцатого века. Дескать, с выбросом амилоида А в кровь при раке не связано никакой гипотезы, что за невежество!
В медицинском плане об амилоиде А нам думать расхотелось. Прямое профилирование плазмы крови на времяпролетных масс-спектрометрах с лазерной ионизацией было заброшено. Морально устаревший прибор SELDI я чуть позже передал на Физтех, где он был разобран до винтиков местными суровыми обитателями. Но все же меня не покидало состояние какой-то незавершенности. Ведь в глубине души я полагал, что амилоид А может участвовать в патогенезе рака. Тем более, функция этого белка, открытого много лет назад, была, по сути, неизвестной. А если мы не знаем, что белок делает в норме, как мы можем утверждать, что он не участвует в развитии патологии?
Накапливались разрозненные сведения о том, что белки SAA активно синтезируются не только клетками печени, но и опухолевыми клетками. Это заставило нас внимательно отнестись к связи амилоида А с механизмами развития рака. В 2006 году мы даже написали на эту тему обзор литературы [10], но, честно говоря, ясного понимания того, как он может помогать болезни прогрессировать, достичь не смогли из-за недостатка сведений. Ситуация изменилась спустя несколько лет, когда в литературе появились данные о том, что амилоид А способен связываться с рецептором FPR2 на поверхности нейтрофилов, заставляя их проявлять иммуносупрессорные свойства [11]. Вообще идея того, что нейтрофилы способны к иммуносупрессии, появилась в иммунологии сравнительно недавно. Все медики и биологи помнят, что нейтрофилы позиционируются в учебниках как непримиримые борцы с бактериальными клетками. Однако постепенно стало выясняться, что почти все типы клеток миелоидного ряда содержат субпопуляции, способные оказывать иммуносупрессорное действие, в том числе на Т-клеточный иммунитет. В частности, таким свойством обладают и зрелые нейтрофилы [12].
Уже бросив к тому времени заниматься амилоидом А, я, тем не менее, суммировал собственные знания о его роли при раке и последние на тот момент литературные данные о его взаимодействии с иммунными клетками в небольшом обзоре [5]. Гипотеза, сформулированная к тому времени, заключалась в следующем (рис. 3а). Клетки опухолей выделяют SAA острой фазы, который воздействует на находящиеся в составе опухоли нейтрофилы. Они под воздействием амилоида А проявляют иммуносупрессорные свойства и подавляют Т-клеточный ответ на опухоль. Последняя получает от выброса SAA существенные преимущества. Это мнение, сформированное в общем виде, в последующие годы не нашло убедительного подтверждения. При этом управление Т-клеточным иммунитетом, которое осуществляют клетки сóлидных (плотных, или твердых) опухолей, оказалось в центре внимания. В итоге, были разработаны хорошо известные сейчас противораковые лекарства — ингибиторы иммунного «контрольно-пропускного пункта» .
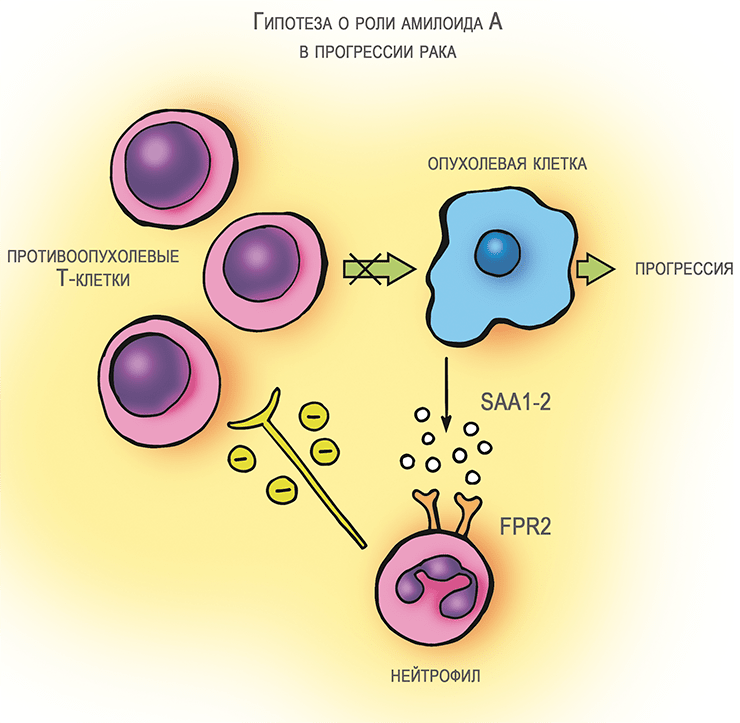
Рисунок 3а. Амилоид A и рак. Гипотеза об участии амилоида А (SAA1-2) в ослаблении противоопухолевого иммунитета [5], [11].

Рисунок 3б. Амилоид A и рак. Доказанная роль амилоида А (SAA1-2) в метастазировании рака поджелудочной железы в печени [16].
Прочно забыв о теме амилоида А, некоторое время назад я пролистывал хрустящие электронные страницы журнала Nature и вдруг наткнулся на материал Ли и соавторов, непосредственно связанный с участием этого белка в прогрессии рака [16]. С использованием нескольких линий трансгенных мышей с опухолями поджелудочной железы и клинического материала от пациентов был убедительно доказан механизм участия амилоидов А острой фазы в метастазировании рака этого типа в печень. Как выяснилось, клетки рака поджелудочной железы выделяют в кровоток интерлейкин-6 (IL6), известный индуктор острой фазы воспаления. Интерлейкин воздействует на гепатоциты, в которых путем фосфорилирования вызывает активацию транскрипционного фактора STAT3. Последний стимулирует усиленную экспрессию амилоида А — двух сходных продуктов генов SAA1 и SAA2. А они, как уже было известно до того, привлекают в ткань печени путем хемотаксиса иммуносупрессорные миелоидные клетки, характеризующиеся поверхностным маркером Ly6G [17]. Кроме того, SAA обеспечивают синтез и отложение в ткани печени белков внеклеточного матрикса (например, фибронектина).
Известно, что сóлидные злокачественные опухоли выделяют в кровоток много циркулирующих раковых клеток. Однако совсем немногие из них образуют отдаленные метастазы в других органах, причем печень — одно из основных направлений метастазирования. Для того чтобы циркулирующие клетки прижились, в ткани должны создаваться так называемые «метастатические ниши» [18]. В статье Ли и соавторов [16] проиллюстрировано, что метастатическая ниша в печени как раз образована привлечением иммуносупрессорных клеток одновременно с избыточным синтезом внеклеточного матрикса. Именно эти два события опосредуются сигнальной осью IL6—STAT3—SAA (рис. 3б), причем блокирование любого из ее компонентов путем генного нокаута почти сводило на нет метастазирование в печень в моделях аденокарциномы протоков поджелудочной железы. Сывороточный амилоид А, таким образом, первый раз был признан виновным в прогрессии злокачественной опухоли на доказательной основе. Теперь, по предположению авторов статьи, лекарственное вмешательство в работу «оси зла» IL6—STAT3—SAA способно отменять метастазирование в печень при тех злокачественных опухолях, для которых характерно это явление.
Но для чего же нужен самому организму амилоид А, который при воспалении выделяется печенью системно и в больших количествах? Не для того же, чтобы в случае чего обеспечивать метастазирование рака? Об этом в статье Ли ничего не сказано. Тем не менее можно предполагать, что SAA способен ингибировать иммунные реакции в областях воспаления по принципу отрицательной обратной связи. Хорошо известно, что после того, как инфекция побеждена, избыточные иммунные реакции могут нанести вред организму. Видимо, не случайно амилоидоз А в связи с избытком SAA в крови происходит при системных воспалительных заболеваниях (например, при псориазе), когда иммуносупрессия не справляется с наносимым аутоиммунными реакциями повреждением.
Вот так почти за пятнадцать лет знания об амилоиде А от описательных стали доказательными. Увидеть логическое завершение большой серии работ, особенно, когда ты сам внес свой небольшой вклад в эту область знания, всегда приятно. А меня эта история еще и заставила с грустью вспомнить славные времена, когда мы с коллегами только начинали работать в протеомике.
- 12 методов в картинках: протеомика;
- Sergei A. Moshkovskii, Marina V. Serebryakova, Konstantin B. Kuteykin-Teplyakov, Olga V. Tikhonova, Eugene I. Goufman, et. al.. (2005). Ovarian cancer marker of 11.7 kDa detected by proteomics is a serum amyloid A1. Proteomics. 5, 3790-3797;
- Sergei A. Moshkovskii, Maria A. Vlasova, Mikhail A. Pyatnitskiy, Olga V. Tikhonova, Metanat R. Safarova, et. al.. (2007). Acute phase serum amyloid A in ovarian cancer as an important component of proteome diagnostic profiling. Prot. Clin. Appl.. 1, 107-117;
- Омикс-биомаркеры и ранняя диагностика: когда счастье возможно;
- S. A. Moshkovskii. (2012). Why do cancer cells produce serum amyloid a acute-phase protein?. Biochemistry Moscow. 77, 339-341;
- Болезнь Альцгеймера: ген, от которого я без ума;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?;
- M. A. Vlasova, S. A. Moshkovskii. (2006). Molecular interactions of acute phase serum amyloid A: Possible involvement in carcinogenesis. Biochemistry (Moscow). 71, 1051-1059;
- Carmela De Santo, Ramon Arscott, Sarah Booth, Ioannis Karydis, Margaret Jones, et. al.. (2010). Invariant NKT cells modulate the suppressive activity of IL-10-secreting neutrophils differentiated with serum amyloid A. Nat Immunol. 11, 1039-1046;
- Janesh Pillay, Tamar Tak, Vera M. Kamp, Leo Koenderman. (2013). Immune suppression by neutrophils and granulocytic myeloid-derived suppressor cells: similarities and differences. Cell. Mol. Life Sci.. 70, 3813-3827;
- Кишечная микрофлора: третий нелишний в иммунотерапии рака;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Jae W. Lee, Meredith L. Stone, Paige M. Porrett, Stacy K. Thomas, Chad A. Komar, et. al.. (2019). Hepatocytes direct the formation of a pro-metastatic niche in the liver. Nature. 567, 249-252;
- M. Kowanetz, X. Wu, J. Lee, M. Tan, T. Hagenbeek, et. al.. (2010). Granulocyte-colony stimulating factor promotes lung metastasis through mobilization of Ly6G+Ly6C+ granulocytes. Proceedings of the National Academy of Sciences. 107, 21248-21255;
- Опухолевые разговоры, или Роль микроокружения в развитии рака.
Источник


