Анализ крови с гемосиндромом инвитро
Метод определения
См. в описании
Исследуемый материал
Смотрите в описании
Кровь — это жидкая ткань, выполняющая различные функции, в том числе, транспорта кислорода и питательных веществ к органам и тканям и выведения из них шлаковых продуктов. Состоит из плазмы и форменных элементов: эритроцитов, лейкоцитов и тромбоцитов.
Общий анализ крови в лаборатории ИНВИТРО включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC). Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 119, СОЭ — см. тест № 139.
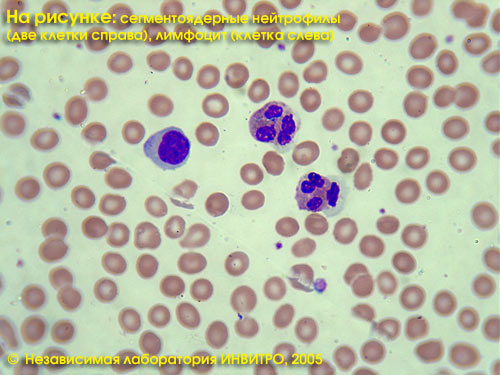
Лейкоцитарная формула — это процентное соотношение различных видов лейкоцитов (нейтрофилы, лимфоциты, эозинофилы, моноциты, базофилы).

Лейкоцитарная формула в Независимой лаборатории ИНВИТРО включает в себя определение (в %) нейтрофилов, лимфоцитов, эозинофилов, базофилов, моноцитов. Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 119, СОЭ — см. тест № 139.
Скорость оседания эритроцитов (СОЭ) — неспецифический показатель воспаления. СОЭ — показатель скорости разделения крови в пробирке с добавленным антикоагулянтом на 2 слоя: верхний (прозрачная плазма) и нижний (осевшие эритроциты). Скорость оседания эритроцитов оценивается по высоте образовавшегося слоя плазмы (в мм) за 1 час. Удельная масса эритроцитов выше, чем удельная масса плазмы, поэтому в пробирке при наличии антикоагулянта (цитрата натрия) под действием силы тяжести эритроциты оседают на дно.
Процесс оседания (седиментации) эритроцитов можно разделить на 3 фазы, которые происходят с разной скоростью. Сначала эритроциты медленно оседают отдельными клетками. Затем они образуют агрегаты — «монетные столбики», и оседание происходит быстрее. В третьей фазе образуется очень много агрегатов эритроцитов, их оседание сначала замедляется, а потом постепенно прекращается.
Показатель СОЭ меняется в зависимости от множества физиологических и патологических факторов. Значения СОЭ у женщин несколько выше, чем у мужчин. Изменения белкового состава крови при беременности ведут к повышению СОЭ в этот период.
Снижение содержания эритроцитов (анемия) в крови приводит к ускорению СОЭ и, напротив, повышение содержания эритроцитов в крови замедляет скорость седиментации. В течение дня возможно колебание значений, максимальный уровень отмечается в дневное время. Основным фактором, влияющим на образование «монетных столбиков» при оседании эритроцитов является белковый состав плазмы крови. Острофазные белки, адсорбируясь на поверхности эритроцитов, снижают их заряд и отталкивание друг от друга, способствуют образованию «монетных столбиков» и ускоренному оседанию эритроцитов.
Повышение белков острой фазы, например, С-реактивного белка, гаптоглобина, альфа-1-антитрипсина, при остром воспалении приводит к повышению СОЭ. При острых воспалительных и инфекционных процессах изменение скорости оседания эритроцитов отмечается через 24 часа после повышения температуры и увеличения числа лейкоцитов. При хроническом воспалении повышение СОЭ обусловлено увеличением концентрации фибриногена и иммуноглобулинов.
Определение СОЭ в динамике, в комплексе с другими тестами, используют в контроле эффективности лечения воспалительных и инфекционных заболеваний. Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 119, СОЭ — см. тест № 139.
Биоматериал – 2 пробирки:
Цельная кровь с ЭДТА
Цельная кровь с цитратом
Обращаем внимание, что при выполнении клинического анализа крови (
№1515
) и подсчете лейкоцитарной формулы (
№119
), если в пробах выявлены значимые отклонения и результат требует проведения ручной микроскопии, ИНВИТРО дополнительно бесплатно проводит ручной подсчет лейкоцитарной формулы с подсчетом молодых форм нейтрофилов (в том числе точным подсчетом палочкоядерных нейтрофилов) и количественной оценкой всех патологических форм лейкоцитов (при их наличии).
Источник
Cтоимость анализов указана без учета взятия биоматериала
Метод определения
метод Фонио (микроскопия окрашенного мазка).
Исследуемый материал
Цельная кровь (с ЭДТА)
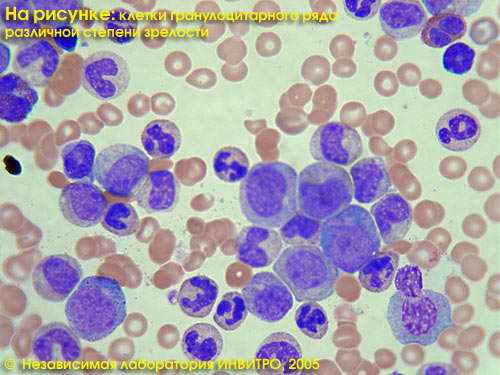
Подсчет тромбоцитов входит в состав общего анализа крови и обычно проводится с помощью гематологического анализатора импедансным методом (см. тест №5 «Общий анализ крови»). В лаборатории ИНВИТРО при всех результатах автоматического определения тромбоцитов менее 130х103 клеток/мкл и более 550х103 клеток/мкл врач дополнительно проводит микроскопию окрашенного мазка крови с подсчетом количества тромбоцитов по методу Фонио. При некоторых клинических состояниях (в том числе при выраженных тромбоцитопениях и тромбоцитозах, при мониторинге терапии) может быть целесообразным подсчет количества тромбоцитов по методу Фонио вне зависимости от концентрации тромбоцитов. Данное исследование решает эту задачу.
Исследование «Тромбоциты, микроскопия» отдельно не выполняется, только в комплексе с тестом №5 «Общий анализ крови», где вместо результата с гематологического анализатора выдаются тромбоциты, подсчитанные по методу Фонио.
Исследование выполняется только из венозной крови.
Литература
- Клиническая лабораторная диагностика. Национальное руководство. В 2 т. — М., ГЭОТАР-Медиа, 2012.
- Льюис С.М., Бэйн Б., Бэйтс И. Практическая и лабораторная гематология. — М. ГЭОТАР-Медиа, 2009, 672 с.
Взятие крови предпочтительно проводить утром натощак, после 8-14 часов ночного периода голодания (воду пить можно), допустимо днем через 4 часа после легкого приема пищи.
Накануне исследования необходимо исключить повышенные психоэмоциональные и физические нагрузки (спортивные тренировки), приём алкоголя.
- диагностика полицитемий, тромбоцитопений, тромбоцитозов;
- мониторинг терапии.
Интерпретация результатов
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения в лаборатории ИНВИТРО: тыс./мкл (103 клеток/мкл).
Альтернативные единицы измерения: 109 клеток/л.
Коэффициенты пересчета: 109 клеток/л = 103 клеток/мкл = тыс./мкл.
Референсные значения:
| Возраст | Концентрация тромбоцитов, тыс./мкл (103 клеток/мкл) | |
| Дети | мальчики | девочки |
| 218 — 419 | 144 — 449 | |
| 2 нед. — 1 мес. | 248 — 586 | 279 — 571 |
| 1 — 2 | 229 — 562 | 331 — 597 |
| 2 — 6 | 244 — 529 | 247 — 580 |
| 6 месяцев — 2 года | 206 — 445 | 214 — 459 |
| 2 года — 6 лет | 202 — 403 | 189 — 394 |
| Возраст | Концентрация тромбоцитов, тыс./мкл (103 клеток/мкл) | |
| > 6 лет | 150 — 400 | |
Интерпретация результатов
Повышение значений (тромбоцитоз)
Функциональные (реактивные) тромбоцитозы:
- физическое перенапряжение;
- воспалительные процессы (системные воспалительные заболевания, остеомиелит, туберкулез);
- анемии вследствие кровопотерь, некоторые виды гемолитических анемий;
- состояния после хирургического вмешательства;
- онкологические заболевания (не гемобластозы);
- спленэктомия;
- острая кровопотеря или гемолиз. Опухолевые тромбоцитозы:
- миелопролиферативные заболевания, в том числе эритремия, идиопатическая геморрагическая тромбоцитемия.
Снижение значений (тромбоцитопения)
Врожденные тромбоцитопении:
- синдром Вискотта-Олдрича;
- синдром Чедиака-Хигаси;
- синдром Фанкони;
- аномалия Мей-Хегглина;
- синдром Бернара-Сулье (синдром гигантских тромбоцитов). Приобретенные тромбоцитопении:
- идиопатическая аутоиммунная тромбоцитопеническая пурпура;
- лекарственная тромбоцитопения;
- системная красная волчанка;
- тромбоцитопения, ассоциированная с инфекцией (вирусные и бактериальные инфекции, риккетсиоз, малярия, токсоплазмоз);
- спленомегалия;
- апластическая анемия и миелофтиз (замещение костного мозга опухолевыми клетками или фиброзной тканью);
- метастазы опухолей в костный мозг;
- мегалобластные анемии;
- пароксизмальная ночная гемоглобинурия;
- синдром Фишера-Эванса (аутоиммунная гемолитическая анемия и тромбоцитопения);
- ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания);
- массивные гемотрансфузии, экстракорпоральное кровообращение;
- в период новорожденности (недоношенность, гемолитическая болезнь новорожденных, неонатальная аутоиммунная тромбоцитопеническая пурпура);
- застойная сердечная недостаточность;
- тромбоз почечных вен.
Лекарственные средства:
- противоопухолевые препараты, назначаемые в достаточных дозах, которые действуют на всех больных (актиномицин D, аспарагиназа, азатиоприн, бисульфан, хлорамбуцил, цисплатин, циклофосфамид, цитарабин, дикарбазин, диунорубицин, доксорубицин, этопозид, мехлорэтамин, меркаптопурин, метотрексат, нитрозомочевина, пликамицин, прокарбазин, тиогуанин, винбластин, винкристин – редко);
- повышенная чувствительность отдельных лиц к действию лекарственных препаратов: некоторых анальгетиков (ацетаминофен, антипирин, аспирин, кодеин, меперидин, формин, нестероидных противовоспалительных препаратов (ибупрофен, индометацин, напроксен, оксифенбутазон, фунацетин, фенилбутазон, параметадион, фенитоин, триметадион, вальпроевая кислота), антигистаминных препаратов (хлорфенирамин, дифенгидрамин), противомикробных препаратов (p-аминосалициловая кислота, амфотерицин В, цефалоспорины, хлорамфеникол, клондамицин, клотримазол, эритромицин, изониазид, новобиоцин, органические препараты мышьяка, пенициллин, пиразинамид, рифампицин, стибофен, стрептомицин, сульфаниламиды, тетрациклины, ванкомицин), антитиреоидных препаратов (метимазол, пропилтиоурацил, тиоурацил), сердечно-сосудистых препаратов (алпренолол, амиодарон, амринон, каптоприл, дигитоксин, мексилетин, нитроглицерин, оксипренолол, хинидин, резерпин, токаинид), диуретиков (ацетазоламид, буметанид, диазоксид, фуросемид, ртутные диуретики, тиазиды, триамтерен), металлов (висмут, ртуть, соединения золота, серебро), гипогликемических препаратов (карбутамид, хлорпропамид, глибенкламид, инсулин, толбутамид), психотропных препаратов (амитриптиллин, дезипрамин, барбитураты, мепробамат, хлорпропазин, трифлуоперазин), других препаратов (аллопуринол, хлорохин, циметидин, колхицин, циклоспорин, декстроамфетамин, динитрофенол, спорынья, эстрогены, ганцикловир, гепарин, гидроксихлорохин, альфа-интерферон, левамизол, метилдопа, пеницилламин, иодид калия, преднизон, прокаин, хинин, ранитидин, тимоксифен, тиклопидин, витамин К), алкоголя.
Артикул:
TRO
Срок исполнения:
1 рабочий день ?
Указанный срок не включает день взятия биоматериала
Цена:
250 руб
Взятие крови из вены:
- + 220 руб
Анализ крови. Общий анализ крови (без лейкоцитарной формулы и СОЭ) (Complete Blood Count, CBC):
- + 330 руб
В этом разделе вы можете узнать, сколько стоит выполнение данного исследования в вашем городе, ознакомиться с описанием теста и таблицей интерпретации результатов. Выбирая, где сдать анализ «Тромбоциты, микроскопия (подсчет в окрашенном мазке по методу Фонио)» в Москве и других городах России, не забывайте, что цена анализа, стоимость процедуры взятия биоматериала, методы и сроки выполнения исследований в региональных медицинских офисах могут отличаться.
Источник
Метод определения
Real-time-PCR.
Исследуемый материал
Цельная кровь (с ЭДТА)
Расширенное исследование генов системы гемостаза: F2, F5, MTHFR, MTR, MTRR, F13, FGB, ITGA2, ITGВ3, F7, PAI-1
Комплексное исследование генетических факторов риска развития нарушений в системе свертывания крови и фолатном цикле.
Различные изменения в генах системы гемостаза и цикла обмена фолатов предрасполагают к развитию большого числа патологических состояний: инфаркты, инсульты, тромбоэмболии, кровотечения, патология беременности и родов, осложнения послеоперационного периода и т.д.
Профиль включает в себя исследование основных полиморфизмов в генах системы гемостаза и фолатного цикла:
- F2 c.*97G>A (20210 G>A; rs1799963),
- F5 c.1601G>A (Arg534Gln; 1691 G>A; rs6025),
- MTHFR c.665C>T (Ala222Val; 677 C>T; rs1801133),
- MTHFR c.1286A>C (Glu429Ala; 1298 A>C; rs1801131),
- MTR c.2756A>G (Asp919Gly; rs1805087),
- MTRR c.66A>G (Ile22Met; rs1801394),
- F13 с.103G>T (I63Т; rs5985),
- FGB c.-467G>A (-455 G>А; rs1800790),
- ITGA2 c.759C>T (Phe253Phe, 807 C>T; rs1126643),
- ITGB3 c.176T>C (Leu59Pro; 1565 T>C; rs5918),
- F7 c.1238G>A (Arg353Gln; 10976 G>A; rs6046),
- PAI-1 (SERPINE1) –675 5G>4G (rs1799889).
Ген F2 кодирует аминокислотную последовательность белка протромбина. Полиморфизм F2 c.*97G>A приводит к повышенной экспрессии гена. Клинически неблагоприятный вариант полиморфизма (c.*97A) наследуется по аутосомно-доминантному типу. Наличие полиморфизма F2 c.*97G>A в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне курения — в 40 и более раз) увеличивает риск возникновения венозных тромбозов, в том числе тромбозов сосудов мозга и сердца, особенно в молодом возрасте. У пациентов-носителей данного полиморфизма повышен риск развития тромбоэмболий после хирургических вмешательств. Приём оральных контрацептивов у данной группы лиц также увеличивает риск тромбозов (относительный риск развития тромбофилии и венозной тромбоэмболии у гетерозиготных носительниц полиморфизма c.*97G>A возрастает в 16 раз).
Ген F5 кодирует аминокислотную последовательность белка проакцелерина — коагуляционного фактора 5. Нуклеотидная замена c.1601G>A («мутация Лейден») приводит к аминокислотной замене аргинина на глутамин в позиции 534, что придает устойчивость активной форме проакцелерина. Клинически это проявляется рецидивирующими венозными тромбозами и тромбоэмболиями. Наличие полиморфизма в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне заместительной гормонотерапии или приема оральных контрацептивов — в 30 и более раз) увеличивает риск венозных тромбозов. Риск инфаркта миокарда увеличивается в 2 и более раз, риск развития патологии беременности (прерывание беременности, преэклампсия, хроническая плацентарная недостаточность и синдром задержки роста плода) увеличивается в 3 и более раз.
Также, пациенты, являющиеся одновременно носителями полиморфизма c.*97G>A гена протромбина и «мутации Лейден», еще в большей степени подвержены риску развития тромбозов и тромбоэмболий.
Ген MTHFR кодирует аминокислотную последовательность фермента метилентетрагидрофолатредуктазы, играющего ключевую роль в метаболизме фолиевой кислоты. Полиморфизм c.665C>T гена MTHFR связан с заменой нуклеотида цитозина (С) на тимин (Т), что приводит к аминокислотной замене аланина на валин в позиции 222. Вариант c.665Т связан с четырьмя группами мультифакториальных заболеваний: сердечно-сосудистыми, дефектами развития плода, колоректальной аденомой и раком молочной железы и яичников. У женщин с генотипом c.665Т/Т дефицит фолиевой кислоты во время беременности может приводить к порокам развития плода, в том числе незаращению нервной трубки. Неблагоприятное воздействие варианта c.665Т- зависит от внешних факторов: низкого содержания в пище фолатов, курения, приема алкоголя. Сочетание генотипа c.665Т/Т и папилломавирусной инфекции увеличивает риск цервикальной дисплазии. Назначение препаратов фолиевой кислоты может значительно снизить негативное влияние данного варианта полиморфизма.
Полиморфизм MTHFR c.1286A>C связан с точечной заменой нуклеотида аденина (А) на цитозин (С), что приводит к замене аминокислотного остатка глутаминовой кислоты на аланин в позиции 429, относящейся к регулирующей области молекулы фермента. При наличии данного полиморфизма отмечается снижение активности фермента MTHFR. Это снижение обычно не сопровождается изменением уровня гомоцистеина в плазме крови у носителей дикого варианта полиморфизма c.665C>T, однако сочетание аллельного варианта* c.1286C с аллелем c.665T приводит к снижению уровня фолиевой кислоты и соответствует по своему эффекту гомозиготному состоянию MTHFR c.665Т/T. При этом риск развития дефектов нервной трубки повышается в 2 раза. Жизнеспособность плодов, имеющих одновременно оба полиморфных варианта, также снижена.
Ген MTR кодирует аминокислотную последовательность фермента метионин синтазы. Полиморфизм c.2756A>G связан с аминокислотной заменой (аспарагиновой кислоты на глицин) в молекуле фермента. В результате этой замены функциональная активность фермента изменяется, что приводит к повышению риска формирования пороков развития у плода. Влияние полиморфизма усугубляется повышенным уровнем гомоцистеина.
Ген MTRR кодирует аминокислотную последовательность фермента редуктазы метионинсинтазы. Полиморфизм c.66A>G связан с аминокислотной заменой в молекуле фермента. В результате этой замены функциональная активность фермента снижается, что приводит к повышению риска развития дефектов нервной трубки у плода. Влияние полиморфизма усугубляется дефицитом витамина В12. При сочетании полиморфизма c.66A>G гена MTRR с полиморфизмом c.665C>T в гене MTHFR риск spina bifida увеличивается. Полиморфизм c.66A>G гена MTRR усиливает гипергомоцистеинемию, вызываемую полиморфизмом c.665C>T в гене MTHFR.
Ген фибриназы (F13) кодирует синтез трансглютаминазы, участвующей в стабилизации фибринового сгустка и в формировании соединительной ткани. Аллельные варианты с.103G/Т и с.103Т/Т приводят к снижению уровня трансглютаминазы с образованием сетчатой структуры фибрина с более тонкими волокнами, меньшими порами, и изменением характеристик проникновения, которое в сочетании с другими факторами риска ассоциируется с возможным риском внутричерепных кровоизлияний и кровотечений из внутренних органов, а также привычным невынашиванием беременности. При этом аллельный вариант с.103Т может выступать в роли протективного фактора в отношении инфаркта миокарда и венозных тромбозов.
Ген FGB кодирует β-цепь фибриногена, являющегося предшественником фибрина. Аллельный вариант c.-467А обусловливает усиленную транскрипцию гена и может приводить к увеличению уровня фибриногена в крови и повышению вероятности образования тромбов при наличии дополнительных факторов риска. Гетерозиготный вариант c.-467G/А связывают с повышенным риском ишемического инсульта и лакунарными инфарктами церебральных сосудов. Гомозиготный вариант c.-467A/А связывают с повышенным риском инфаркта миокарда.
Ген гликопротеина Gp1a (ITGA2) кодирует синтез альфа-2-субъединицы интегринов – специализированных рецепторов тромбоцитов. Аллельный вариант c.759Т вызывает изменение первичной структуры субъединицы и свойств рецепторов. При гетерозиготном (c.759C/T) варианте отмечается увеличение скорости адгезии тромбоцитов к коллагену I типа, что может приводить к повышенному риску тромбофилии, инфаркта миокарда и других сердечно-сосудистых заболеваний. Аллельный вариант c.759Т связывают со случаями резистентности к аспирину. Помимо этого, при гомозиготном (c.759Т/T) варианте значительно увеличивается количество рецепторов на поверхности тромбоцитов. В совокупности, при гомозиготном варианте данного полиморфизма значительно повышен риск тромбофилии, инфаркта миокарда и развития других острых эпизодов тромбообразования в возрасте до 50 лет, даже по сравнению с гетерозиготным вариантом.
Ген гликопротеина Gp3a (ITGB3) кодирует синтез бета-3 цепи интегринового комплекса GP2b3a, участвующего в разнообразных межклеточных взаимодействиях (адгезии и сигнализации).
Аллельный вариант c.176С (гетерозигота c.176T/C) обусловливает повышенную адгезию тромбоцитов и может приводить к увеличению риска развития острого коронарного синдрома, а также связан с синдромом привычного невынашивания беременности. Гомозиготный вариант c.176С/C обусловливает повышенную адгезию тромбоцитов и может приводить к значительному увеличению риска развития острого коронарного синдрома в возрасте до 50 лет. У лиц с полиморфными аллельными вариантами часто отмечается пониженная эффективность аспирина.
Аллельный вариант c.1238A (гетерозигота c.1238G/A и гомозигота c.1238А/A) гена F7 приводит к понижению экспрессии гена и снижению уровня фактора 7 в крови, рассматривается как протективный маркёр в отношении развития тромбозов и инфаркта миокарда.
Ген ингибитора активатора плазминогена (PAI-1) кодирует белок-антагонист тканевого и урокиназного активатора плазминогена. Преобладающим в популяции вариантом исследуемого полиморфизма является гетерозиготный вариант -675 5G/4G. В связи с этим данный полиморфизм самостоятельного диагностического значения не имеет, эффект возможно оценить в сочетании с другими факторами предрасполагающими к развитию патологии (например в сочетании с FGB c.-467A). Аллельный вариант -675 4G сопровождается большей активностью гена, чем -675 5G, что обусловливает более высокую концентрацию PAI-1 и уменьшение активности противосвёртывающей системы. Гомозигота -675 4G/4G ассоциирована с повышением риска тромбообразования, преэклампсии, нарушением функции плаценты и самопроизвольного прерывания беременности.
*Примечание: иногда в научной литературе при описании однонуклеотидных замен, характерных для генных полиморфизмов, встречается термин «мутантный аллель». Это терминологическая неточность, так как в классической генетике термин «мутантный аллель» традиционно рассматривается как синоним термина «мутация». При мутациях, как известно, изменение структуры гена приводит к образованию (экспрессии) нефункциональных белков и к неизбежному развитию наследственного заболевания. При полиморфизмах изменение в структуре гена приводит лишь к появлению белков с немного изменёнными физико-химическими свойствами. Такие изменения, как известно, проявляют себя при воздействии на организм различных факторов внешней среды или при изменении функционального состояния организма человека. И только в таких ситуациях функционирование белков со структурными особенностями может, либо способствовать ускорению развития заболевания, либо, напротив, тормозить формирование патологических процессов. Поэтому, на наш взгляд, для разграничения изменений в генах столь очень похожих структурно, но приводящих к несоизмеримо разным последствиям для организма, корректнее в отношении генных полиморфизмов применять понятие «аллельный вариант гена», а не «мутантный аллель».
Литература
- Никитина Л.А. и др. Роль некоторых генетических полиморфизмов в невынашивании беременности // Проблемы репродукции, 2007, С.83-89.
- Güngör et al. The presence of PAI-1 4G/5G and ACE DD genotypes increases the risk of early-stage AVF thrombosis in hemodialysis patients. // Ren Fail. 2011;33(2):169-7
- Wei YS, et al. Association of the integrin gene polymorphisms with ischemic stroke and plasma lipid levels // Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 2009;26(2):211-5
- Gohil et al., The genetics of venous thromboembolism. A meta-analysis involving approximately 120,000 cases and 180,000 controls // Thromb Haemost, 2009. 102(2): 360-70
- Goodman et al., Which thrombophilic gene mutations are risk factors for recurrent pregnancy loss? // Am J Reprod Immunol, 2006. 56(4):230-6
- Gerhardt, A., et al. The polymorphism of platelet membrane integrin alpha2beta1 (alpha2807TT) is associated with premature onset of fetal loss // Thromb Haemost, 2005. 93(1):124-9.
- Ruzzi, L., et al., Association of PLA2 polymorphism of the ITGB3 gene with early fetal loss // Fertil Steril, 2005. 83(2): 511-2
- База OMIM: https://omim.org/entry/176930
- База OMIM: https://omim.org/entry/227400
- База OMIM +227400 https://omim.org/entry/607093
- База OMIM: https://omim.org/entry/602568
- База OMIM: https://omim.org/entry/156570
- https://www.ncbi.nlm.nih.gov/clinvar/RCV000012861/
Источник