Анализ крови на иммунохроматографический анализ
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 января 2017;
проверки требуют 4 правки.
Иммунохроматографический анализ (ИХА) — иммунохимический метод анализа, основанный на принципе тонкослойной хроматографии и включающий реакцию между антигеном и соответствующем ему антителом в биологических материалах. Проводится с помощью специальных тест-полосок, панелей или тест-кассет.
Сущность метода[править | править код]
Принцип действия состоит в том, что при погружении тест-полоски в биологическую жидкость (или другой жидкий образец), она начинает мигрировать вдоль полоски по принципу тонкослойной хроматографии. Вместе с ней движутся нанесенные на нижнюю часть тест-полоски меченые специфические антитела, которые аффинно связываются с анализируемым веществом.
Различают 2 формата ИХА: прямой и конкурентный метод.
- В схеме прямого (сэндвичного) ИХА используется конъюгат антитела-метка, нанесенный на мембрану для конъюгата. На тестовой линии иммобилизованы антитела, специфические к данному аналиту, а на контрольной линии – антивидовые антитела, специфические к первичным антителам. При нанесении образца, содержащего анализируемое вещество, при попадании образца на мембрану с конъюгатом, происходит связывание аналита с конъюгатом Ат-метка. Затем иммунный комплекс попадает в тестовую зону, где он связывается со специфическими антителами, образуя «сэндвич» Ат-Аг-Ат-метка. Избыток несвязавшегося конъюгата связывается с антивидовыми антителами на контрольной линии. Таким образом, выявление 2-х линий на тест-полоске является положительным результатом теста. При отсутствии аналита в образце конъюгат связывается с антивидовыми антителами только на контрольной линии, образуя одну линию на тест-полоске.
Метод прямого ИХА используется для выявления высокомолекулярных соединений – вирусов, в т.ч. ВИЧ; различных гормонов (например, в тестах на беременность), возбудителей инфекционных заболеваний. - Метод конкурентого ИХА, используемый для определения низкомолекулярных соединений, основан на конкуренции аналита и иммобилизованного конъюгата аналит:белок-носитель за ограниченное количество центров связывания специфических антител, содержащихся в конъюгате Ат-метка. При нанесении образца, содержащего аналит, он связывается с конъюгатом Ат-метка на мембране с конъюгатом. Далее иммунокомплекс проходит через тестовую зону, где иммобилизован конъюгат аналит:белок-носитель. Иммунокомплекс не может связаться с этим конъюгатом из-за стерических затруднений: низкомолекулярные соединения обычно имеют одну антигенную детерминанту и, соответственно, антитела имеют один центр связывания с антигеном, который уже является занятым аналитом. Далее иммунный комплекс связывают антивидовые антитела, находящиеся на контрольной линии. В результате, отсутствие окрашенной полосы в тестовой зоне и наличие окраски в контрольной зоне свидетельствует о том, что концентрация определяемого вещества в исследуемом образце превышает его пороговое значение для данного теста.
При отсутствии анализируемого вещества в образце, конъюгат Ат-метка связывается с конъюгатом Аг:белок-носитель, иммобилизованным в зоне тестовой линии. Несвязавшийся конъюгат Ат-метка попадает в зону контрольной линии и связывается там с антивидовыми антителами. Таким образом, наличие двух окрашенных линий (тестовой и контрольной) является отрицательным результатом анализа.
Формат конкурентного ИХА используется для выявления низкомолекулярных соединений, в том числе метаболитов наркотических соединений в моче, жидкости ротовой полости, экстрактах тканей.
Преимуществом метода является быстрота его и легкость его применения, возможность использования неприборных форматов ИХА с визуальной оценкой результата анализа. В этом случае не требуется использование никакого оборудования и анализ может быть проведен неспециалистом в любых условиях, в т.ч. «полевых».
Существуют также приборные полуколичественные и количественные форматы ИХА, в которых используются специальные ридеры для регистрации интенсивности метки в тестовой зоне тест-полоски.
Метки, используемые в ИХА[править | править код]
В качестве меток в ИХА используются различные частицы, обладающие следующими свойствами:
- Красящие вещества (нано-частицы коллоидного золота или углерода, или частицы окрашенного латекса). В этом случае используется визуальная детекция результата, либо приборное колориметрическое определение (или сканирование). Использование различных красящих меток, присоединенных к частицам латекса, позволяет проводить мильтианализ, в котором линии разного цвета соответствуют различным аналитам. Наиболее часто используемой меткой является нано-частицы коллоидного золота.
- Флуоресцентные, фосфоресцентные и биолюминисцентные метки, ковалентно связанные с частицами латекса. Эти метки используются только в приборных вариантах ИХА, когда результат регистрируется специальным ридером. Среди вышеуказанных наиболее распространены флуоресцентные метки.
- Парамагнитные метки (также закрепленные на частицах латекса). Данный вид меток используется в ИХА с применением приборов, регистрирующих силу магнитного поля.
- Ферментные метки используются по тому же принципу, что и в ИФА. Ферментативная реакция регистрируется с помощью окрашивания субстратов, и результат анализа является визуальным, или считывается с помощью ридера.
- Новым направлением в разработке различных разновидностях ИХА является использование липосом в качестве носителей различного рода меток (красящих, флуоресцентных, ферментативных, электроактивных и пр.).
Литература[править | править код]
- Raphael C. Wong l Harley Y. Tse (Editors) Lateral Flow Immunoassay. Springer, USA, 2009.
Ссылки[править | править код]
- Иммунохроматографический анализ (doc). Дата обращения 1 января 2010. Архивировано 14 апреля 2012 года.
Источник
Что представляет собой иммунохроматографический анализ (ИХА)? Разберемся подробнее в этом вопросе.
ИХА – иммунохимический способ анализа, который основан на методе тонкослойной хроматографии. Он включает реакцию между соответствующим антителом и антигеном в биологических материалах. Осуществляется посредством особых тест-полосок, тест-кассет или панелей. ИХА – это экспресс-тест.
Сущность данного метода исследования
Действие его основывается на том, что при погружении в биологическую жидкость (либо другой жидкий образец) теста она начинает двигаться вдоль полоски по методу тонкослойной хроматографии. Движутся вместе с ней нанесенные на нее специфические меченые антитела, которые связываются аффинно с анализируемым компонентом.

Различаются два формата анализа: прямой и конкурентный метод.
Прямой метод
В формате сэндвичного (прямого) иммунохроматографического анализа крови используется конъюгат антитела-метки, который наносится для конъюгата на мембрану. Иммобилизованные антитела на полоске, обладающие конкретным аналитом, на контрольной линии – антитела антивидовые, специфические к антителам первичным.
При внесении образца, в котором содержится конъюгат (искомое вещество), на мембрану, связывается искомый компонент с конъюгатом Ат-метки. После этого сформированный иммунный комплекс проникает в тестовую зону, где происходит связь со специфическими антителами, и образуется «сэндвич» Ат- Аг-Ат-метка. Затем чрезмерное количество не связавшегося конъюгата соединяется на контрольной линии с антивидовыми антителами. Если на тест-полоске появляются две линии, то результат теста положительный. Если аналит отсутствует в образце, то связывается конъюгат с антивидовыми антителами лишь на контрольной линии, и образуется одна линия.
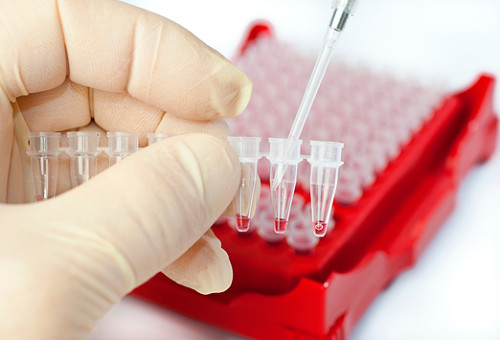
Прямой ИХА применяется для определения возбудителей инфекционных патологий, вирусов – высокомолекулярных соединений, включая разные гормоны, ВИЧ.
Конкурентный метод исследования
Способ конкурентного иммунохроматографического анализа применяется для установления низкомолекулярных соединений. Основан он на конкуренции иммобилизованного конъюгата аналит и аналита: носитель-белок за ограниченное число центров связывания периферических антител, которые содержатся в конъюгате Ат-метка. Когда наносится образец, содержащий аналит, то последний связывается на мембране с конъюгатом с конъюгатом Ат-метка. Иммунокомплекс в дальнейшем проходит через тестовую зону, в которой иммобилизуется конъюгат аналит, то есть белок-носитель.
С этим конъюгатом не может связаться иммунокомплекс из-за стерических сложностей: низкомолекулярные соединения чаще всего обладают одной антигенной детерминантой, таким образом, у иммуноглобулинов есть один центр связи с антигеном, который уже занят до этого аналитом. Иммунный комплекс впоследствии связывается антивидовыми иммуноглобулинами, которые находятся на контрольной линии. Если в тестовой области отсутствует окрашенная полоса и есть окраска в контрольной зоне, это говорит о том, что содержание определяемого компонента в исследуемом образце выше порогового значения для такого теста. Если в аналите отсутствует анализируемое вещество в образце, то происходит связь конъюгата Ат-метка с конъюгатом Аг: носитель-белок, иммобилизованный в области тестовой линии. Ат-метка свободный конъюгат попадает в сферу контрольной линии, где связывается с антивидовыми антителами. Если есть две окрашенные линии (контрольная и тестовая), то можно говорить об отрицательном результате теста.
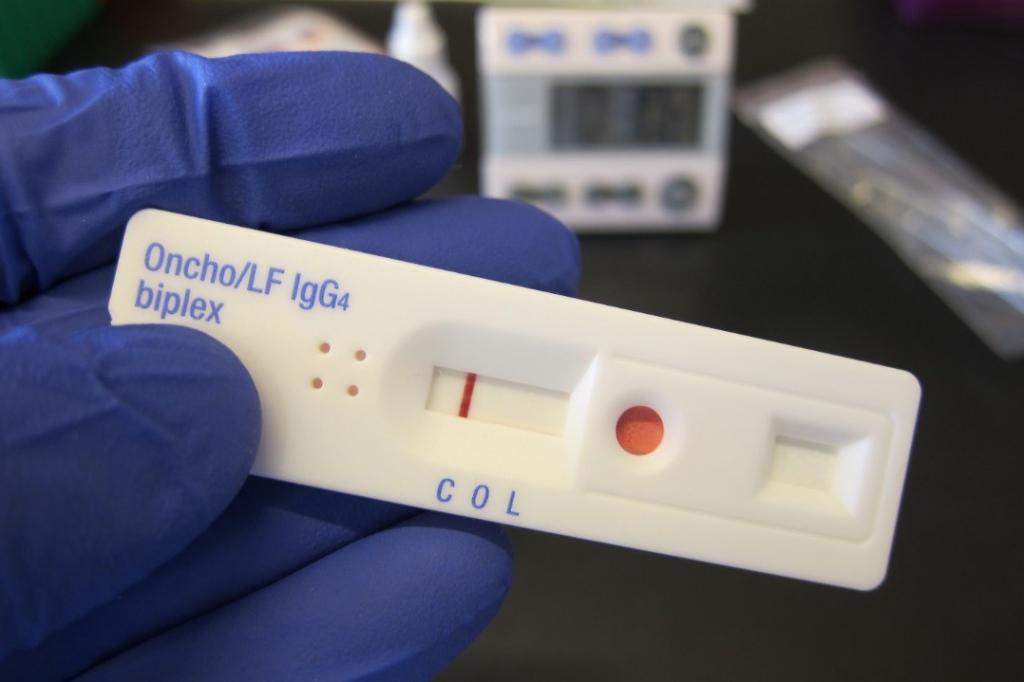
Метод конкурентного ИХА применяется для определения низкомолекулярных соединений, включая тканевые экстракты.
Преимущество такого способа – легкость и быстрота использования, возможность применения неприборных методов ИХА с оценкой результата визуально. Не требуется дополнительное оборудование, и анализ может провести человек без медицинского образования в любое время.
Какие применяются метки в ИХА?
В иммунохроматографическом анализе в качестве меток применяются разные частицы и вещества.
- Красители (частицы крашеного латекса, или наночастицы углерода, или коллоидного золота). Такой вариант позволяет визуально отслеживать результат или определить колориметрическим прибором. Применение красящих меток, которые присоединяются к носителю, позволяет делать мультианализ, где разноцветные линии соответствуют разным аналитам. Используемой меткой чаще всего выступают наночастицы золота коллоидного.

- Связанные ковалентно с латексными частицами биолюминесцентные, фосфоресцентные и флуоресцентные метки. Применяются лишь в приборных способах ИХА, в которых регистрируется результат особым ридером. Наиболее распространенными являются флуоресцентные метки.
- Парамагнитные метки, закрепленные на латексных частицах. Метод применяется в ИХА с использованием приборов, которые регистрируют силу магнитного поля.
- Липосомы, используемые в качестве носителей разных меток (электроактивных, ферментативных, флуоресцентных, красящих и т. д.) Это новое направление среди разновидностей анализа.
- Ферментные метки, применяемые по принципу ИФА. Регистрация реакции проводится посредством окрашивания субстратов. В итоге получается визуальный результат, либо считывается ридером.
Преимущества данного метода исследования
Главными преимуществами применения метода иммунохроматографического анализа становятся:
- Удобство и простота – позволяет получить результат (первичное представление и анализ причины болезни) без специальных навыков и оборудования.
- Надежность – достоверность тестов достигает 99,8 %, каждый тест при этом имеет внутренний встроенный контроль.
- Анонимность – это особенно важно при определении болезней, передаваемых половым путем, прочих инфекционных болезней, а также установлении употребления наркотических веществ.
- Экономичность – приобрести тест может каждый, экономится время на проведение анализа.
- Независимость – не нуждается в предварительной консультации и рецепте врача.
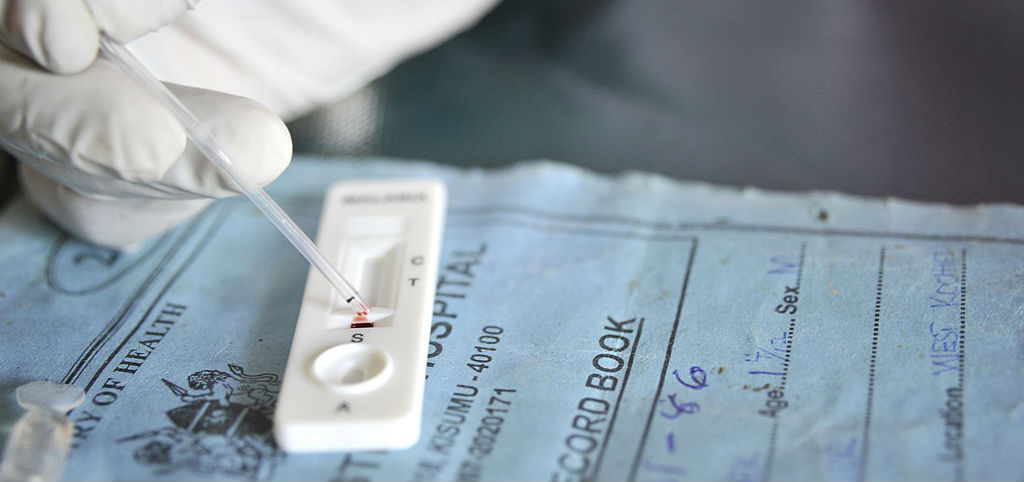
Тест на наркотики как проводится: особенности и недостатки ИХА-метода
Самой популярной услугой становится анализ мочи на наркотики посредством метода иммунохроматографического анализа. Это позволяет исследовать мочу на 14 видов нарковеществ.
Иммунохроматографический анализ на наркотики также считается экспресс-методом диагностики. Результат теста можно узнать спустя 15 минут. Для проведения данного исследования используют особые тест-полоски, которые пропитаны веществами-индикаторами. Если в моче имеются следы наркотического вещества, цвет полоски меняется. Основной недостаток такого анализа – невозможность определить, какова концентрация вещества и степень наркотического опьянения, таким образом, результаты иммунохроматографического анализа в качестве доказательства в суде использовать не получится.
Каков результат такого анализа?
Если на индикаторах появились две розовые полосы, то делается заключение, что в моче не содержится наркотик, или же его концентрация недостаточна для определения иммунохроматографическим методом. При возникновении одной розовой полосы можно говорить о наличии наркотического вещества: марихуаны, производных эфедрона, опиатов, производных барбитуровой кислоты, амфетаминов, кокаина, фенциклидина, бензодиазепинов, экстази.
Какие можно сделать выводы?
Иммунохроматографический анализ (экспресс-тест) является эффективным средством диагностики, он позволяет визуально на протяжении нескольких минут выявить и оценить концентрацию антигенов, гормонов, антител и других диагностически важных компонентов в человеческом организме. Экспресс-тесты имеют высокую степень точности и чувствительности, обнаруживается более ста видов болезней, а также весь спектр наркотических веществ, и достоверность анализа очень высокая.
Источник
В современной медицинской практике с каждым годом возрастает роль лабораторной диагностики как основного инструмента постановки диагноза и мониторинга терапии. Одним из бурно развивающихся и востребованных методов лабораторной диагностики является иммунохроматографический анализ.
ИММУНОХРОМАТОГРАФИЧЕСКИЙ АНАЛИЗ (ИХА) — это метод определения наличия определенных концентраций веществ в биологических материалах (моча, цельная кровь, сыворотка или плазма крови, слюна, кал и т.д.). Данный вид анализа осуществляется при помощи индикаторных полосок, палочек, панелей или тест-кассет, которые обеспечивают быстроту проведения тестирования. ИХА — сравнительно молодой метод анализа, он часто обозначается в литературе также как метод сухой иммунохимии, стрип-тест, QuikStrip cassette, QuikStrip dipstick, экспресс-тест или экспресс-анализ. Эти названия связаны с быстротой проведения этого метода анализа.
Принцип действия иммунохроматографического теста состоит в том, что при погружении теста в физиологическую жидкость она начинает мигрировать вдоль полоски по принципу тонкослойной хроматографии. Подвижной фазой в данном случае является физиологическая жидкость. Вместе с жидкостью движутся и антитела с красителем. Если в этой жидкости присутствует исследуемый антиген (гормон, инфекционный или онкологический маркер), то происходит его связывание, как с первым, так и со вторым типом антител, что является уже иммунологическим методом анализа. При этом происходит накопление антител с красителем вокруг антител, жестко иммобилизованных в тест-зоне ИХА-полоски, что проявляется в виде яркой темной полосы. Несвязавшиеся антитела с красителем мигрируют далее вдоль полоски и неизбежно взаимодействуют со вторичными антителами в контрольной зоне, где и наблюдается вторая темная полоса. Взаимодействие (и темная полоса) в контрольной зоне должны проявляться всегда (если анализ проведен правильно), независимо от присутствия исследуемого антигена в физиологической жидкости (см.рис.1). Результаты определяются визуально или компьютерной обработкой отсканированного изображения.
Иммунологический метод анализа основан на реакции между антигеном и соответствующим ему антителом. Антиген — это вещество, которое чужеродное для организма человека и которое может запустить иммунную систему (защитную реакцию). Антитела — это белки, которые выделяются клетками нашего организма при внедрении в него антигена. Метод имунной хроматографии основан на особенном свойстве антител связываться с антигеном специфическим (то есть избирательным) образом. Это означает, что каждое антитело узнает и связывается только с определенным антигеном. На этой уникальной особенности антител и основаны все иммунологические методы анализа в том числе и ИХА. Причем определяемым «антигеном» в данном методе анализа может служить и определяемое в биоматериале антитело к инфекционному агенту или аутоантитело, тогда остальные используемые в тесте антитела будут являться антиантителами. В ИХА- тестах используется три типа антител.
1. Растворимые моноклональные антитела к исследуемому антигену или антителу, конъюгированные («сшитые») с коллоидным золотом — красителем, который можно легко идентифицировать даже в самых малых концентрациях. Эти антитела нанесены вблизи участка погружения тест-полоски в физиологическую жидкость (мочу, кровь).
2. Поликлональные антитела к исследуемому антигену или антителу, жестко иммобилизованные в тест-зоне полоски.
3. Вторичные антитела к моноклональным антителам, жестко иммобилизованные в контрольной зоне тест-полоски.
Принцип работы тестов на наркотики несколько отличается от других тест-систем. Устройство ИХА-полоски отличается тем, что в тест-зоне иммобилизованы искусственные антигены, способные специфически связываться со свободными антителами. Если исследуемый антиген (наркотик) НЕ присутствует в физиологической жидкости, участки связывания антител (эпитопы) остаются свободными, и они способны связываться с искусственными антигенами в тест-зоне, образуя темную полосу за счет конъюгированного красителя. Соответственно если исследуемый антиген присутстствует в жидкости, то антитела, связавшись с ним, уже не могут взаимодействовать с антигенами в тест-зоне и образования темной полосы там не происходит. Но в обоих случаях (если анализ проведен правильно) происходит связывание «окрашенных» антител со вторичными антителами в контрольной зоне и образование там темной полосы. Возможные варианты при проведении анализа: одна полоса — положительный результат, две полосы — отрицательный результат, нет полос — анализ проведен неправильно.
Основными преимуществами использования иммунохроматографических тест полосок являются:
1) Простота и удобство — позволяет получить результат (анализ и первичное представление о причине заболевания) без оборудования и специальных навыков
2) Надежность — достоверность тестов достигает 92-99,8%, при этом каждый тест имеет встроенный внутренний контроль
3) Экономичность — минимальные затраты на приобретение теста и экономия времени на проведение обследования. В рознице стоимость одного ИФА-исследования в 5-10 раз дороже ИХА и получение результата минимум на следующий день
4) Анонимность — что особенно важно при выявлении заболеваний, передаваемых половым путем, других инфекционных заболеваний, а также выявлении фактов употребления наркотических веществ
5) Независимость — не требует предварительной медицинской консультации и рецепта врача
Являясь эффективным средством диагностирования, экспресс-тесты позволяют визуально в течение нескольких минут определить и оценить содержание антигенов, антител, гормонов и других диагностически важных веществ в организме человека. Экспресс-тесты отличаются высокой степенью чувствительности и точности, обнаруживая более 100 видов заболеваний, включающих такие распространённые болезни как туберкулёз, сифилис, гонорею, хламидиоз, различные виды вирусных гепатитов, и др., а также всю гамму применяемых наркотических веществ при высокой достоверности определения. Важным преимуществом данного вида тестов является их применение в диагностике in vitro, не требующей непосредственного присутствия обследуемого пациента.
Однако иммунохроматографические тест-полоски не лишены недостатков. Касается это надежности, чувствительности и экономичности тестов. Надежность и чувствительность зависит, во-первых, от качества используемых в тесте моноклональных антител и, во-вторых, от концентрации антигена в биоматериале. Качество моноклональных антител зависит от способов их получения, очистки и фиксации на носителе. Концентрация антигена – от стадии заболевания и количества биоматериала. Количество биоматериала особенно важно при использовании цельной крови. При этом существенную роль играет гематокрит, т.е. соотношение плазмы и форменных элементов. При высоком гематокрите снижается количество плазмы с антигеном, мигрирующей вдоль полоски. Температура, от которой зависит скорость взаимодействие антитела с антигеном, важна только для времени постановки теста. Понятно, что использовать полоски при температуре ниже точки замерзания воды, составляющей основную часть биоматериала, не имеет смысла.
Вызывает большие сомнения экономичность использования экспресс-тестов в бюджетных медицинских организациях, которые занимаются массовой диспансеризацией населения и которым как раз-то удобны и необходимы комплексные стрип-системы из тест-полосок для скринингового выявления различных заболеваний. Обусловлено это низкой стоимостью анализа по бюджетным расценкам. При этом себестоимость тест-полоски в некоторых случаях в 10 раз превосходит оплату анализа.
Список литературы.
1) Wennig R, Moeller MR, Haguenoer JM et al. (1998) Development and evaluation of immunochromatographic rapid tests for screening of cannabinoids, cocaine, and opiates in urine // J. Anal. Toxicol. — V.22 — P.148-155
2) Coons, S.J. A look at the purchase and use of home pregnancy-test kits. Am.Pharm. NS29:46-48, 1989.
3) Bastian, L.A., Nanda, K., Hasselblad, V., and Simel, D.L. Diagnostic efficiency of home pregnancy test kits. A meta-analysis. Arch.Fam.Med. 7:465-469, 1998.
4) Latman, N.S. and Bruot, B.C. Evaluation of home pregnancy test kits. Biomed.Instrum.Technol. 23:144-149, 1989.
5) Hicks, J.M. and Iosefsohn, M. Reliability of home pregnancy-test kits in the hands of laypersons [letter] [published erratum appears in N Engl J Med 1989 Jul 20;321(3):193] [see comments]. N.Engl.J.Med. 320:320-321, 1989.
6) Torlesse, H., Wurie, I.M., and Hodges, M. The use of immunochromatography test cards in the diagnosis of hepatitis B surface antigen among pregnant women in West Africa. Br.J.Biomed.Sci. 54:256-259, 1997.
7) Sato, K., Ichiyama, S., Iinuma, Y., Nada, T., Shimokata, K., and Nakashima, N. Evaluation of immunochromatographic assay systems for rapid detection of hepatitis B surface antigen and antibody, Dainascreen HBsAg and Dainascreen Ausab. J.Clin.Microbiol. 34:1420-1422, 1996.
8) Lein, M., Jung, K., Schnorr, D., Henke, W., Brux, B., and Loening, S.A. Rapid screening of PSA: evaluation of an immunochemical membrane strip test [letter]. Clin.Chem. 41:1545-1547, 1995.
9) Anderson, J.C., Cheng, E., Roeske, M., Marchildon, P., Peacock, J., and Shaw, R.D. Detection of serum antibodies to Helicobacter pylori by an immunochromatographic method. Am.J.Gastroenterol. 92:1135-1139, 1997.
10) Schrier, W.H., Schoengold, R.J., Baker, J.T., Norell, J.L., Jaseph, C.L., Okin, Y., Doe, J.Y., and Chandler, H. Development of FlexSure HP—an immunochromatographic method to detect antibodies against Helicobacter pylori. Clin.Chem. 44:293-298, 1998.
11) Cognein, P., Costa, A., and Giacosa, A. Serodiagnosis of Helicobacter pylori: evaluation of a rapid, miniaturized immunochromatographic test. Eur.J.Cancer.Prev. 3:457-463, 1994.
12) Shirin, H., Bruck, R., Kenet, G., Krepel, Z., Wardi, Y., Reif, S., Zaidel, L., Geva, D., Avni, Y., and Halpern, Z. Evaluation of a new immunochromatographic test for Helicobacter pylori IgG antibodies in elderly symptomatic patients [see comments]. J.Gastroenterol. 34:7-10, 1999.
13) Kagen, L. J. 1973 Myoglobin: Biochemical, physiological and clinical aspects. New York and London Colombian University Press.
14) Drexel, H. et al. 1983 Myoglobinaemia in the early diagnosis of acute myocradial infarction. A m. Heart J. 105: 642-651.
15) McComb, J. M. et al. 1983 Myoglobin in the very early phase of acute myocardial infaretion. Ann Clin. Biochem, 22:152-155.
16) Grenardier, E., Keidar, S., Kahana, L., Alpan, G., Marmur, A., Palant, A. 1983 The roles of serum myoclobin, total CPK, and CK-MB isoenzyme in the acute phase of myocardial infarction. Am. Heart J. 105:408-416.
17) Ellis A. K., Saran, B.R. 1989 Kinetics of myoolobin release and prediction of myocardial myoglobin depletion after coronary artery reperfusion. Circulation 80: 676-682.
18) McComb, J.M. et al. 1984 Myoglobin and creatine kinase in acute myocardial infarction. Br. Heart J. 51:189-194.
19) Struyf, F., Lemmens, A., Valadas, E., Verhaegen, J., and Van Ranst, M. Usefulness of immunochromatographic detection of antibodies to Mycobacterium tuberculosis as an adjunct to auramine staining for rapid diagnosis of tuberculosis in a low-prevalence setting. Eur.J.Clin.Microbiol.Infect.Dis. 18:740-742, 1999.
20) Abe, C., Hirano, K., and Tomiyama, T. Simple and rapid identification of the Mycobacterium tuberculosis complex by immunochromatographic assay using anti-MPB64 monoclonal antibodies. J.Clin.Microbiol. 37:3693-3697, 1999.
Источник


