Анализ крови методом ифа инвитро
Метод определения
Иммуноферментный колориметрический метод.
Исследуемый материал
Сыворотка крови
Определение активности комплемента применительно к классическому, альтернативному и лектиновому путям (раздельно) применяют для скрининга врожденного иммунодефицита.
Комплемент был открыт как термолабильный бактерицидный фактор сыворотки. В современном представлении система комплемента – это сложная система белков сыворотки крови, способных к каскадной активации, включенная в механизмы иммунной защиты и удаления из организма чужеродных клеток, микроорганизмов, продуктов клеточной гибели. Комплемент играет важнейшую роль в обеспечении сопротивляемости инфекциям и поддержании гомеостаза. В организме эта система находится под контролем присутствующих в биологических жидкостях или ассоциированных с мембранами регуляторов. Однако она может быть быстро мобилизована и усилена при необходимости немедленной иммунной реакции на патогенное воздействие.
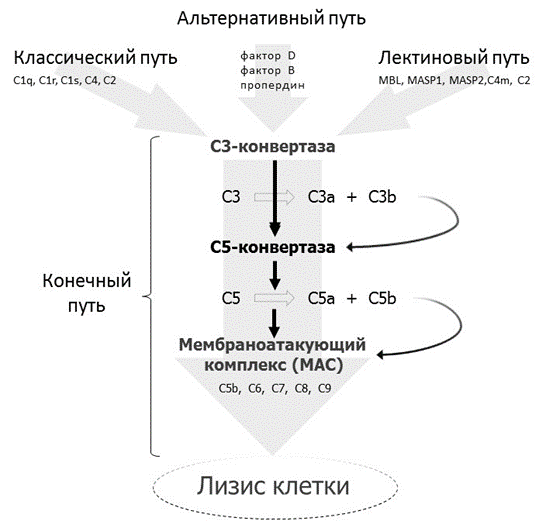
Активация системы комплемента происходит в виде каскадной реакции, которая может осуществляться тремя путями с разными механизмами инициализации (классическим, альтернативным и лектиновым) и общим конечным этапом (Рис.1.). Несоответствующая активация комплемента может вести к хроническому воспалению и повреждению тканей.
Классический путь активации комплемента инициируется комплексами антиген-антитело и агрегированными иммуноглобулинами. Активация альтернативного и лектинового (маннозного) путей не зависит от присутствия антител, индуцируется контактом с определенными структурами бактериальной стенки или иной чужеродной поверхности. Три пути тесно взаимодействуют и сходятся на конечном этапе, что сопровождается формированием опсонинов, анафилотоксинов, хемоаттрактантов и мембраноатакующего комплекса, обеспечивающих эффективный воспалительный и цитолитический ответ на патоген.

Рисунок 1. Схема участия компонентов комплемента в классическом, альтернативном, лектиновом механизмах инициализации и общем конечном пути активации
Каждый из указанных путей активации комплемента может быть задействован не только в механизмах естественной иммунной защиты, но и в патогенезе ряда заболеваний. Дефицит любого из компонентов комплемента приводит к снижению сопротивляемости организма и рецидивирующим инфекциям или несоответствующему воспалительному ответу. Непрерывная патологическая активация комплемента может приводить к повреждению здоровых тканей. Определенные дефекты системы комплемента предрасполагают к развитию аутоиммунной и иммунокомплексной патологии (системной красной волчанки (СКВ), нефритов).
Недостаточность комплемента может быть не только причиной, предрасполагающей к повторным инфекционным заболеваниям и развитию аутоиммунной патологии, но и следствием заболеваний, протекающих с выраженной активацией комплемента. В процессе развития многих инфекционных и аутоиммунных заболеваний происходит повышенное потребление факторов комплемента. Это обнаруживается при лабораторных исследованиях в виде уменьшения концентрации вовлеченных компонентов и снижения функциональной активности соответствующего пути активации комплемента.
Врожденные гомозиготные дефициты компонентов комплемента крайне редки, гетерозиготные (с отсутствием одного аллеля) отмечаются чаще и сопровождаются низким уровнем соответствующих факторов комплемента и снижением его функциональной активности. Приобретенная недостаточность комплемента более распространена. В том числе, как следствие усиленного потребления комплемента в течение иммуновоспалительного процесса или аутоиммунного заболевания.
Предлагаемое исследование комбинирует общие принципы, применяемые в гемолитических методах оценки функции системы комплемента, с использованием иммуноферментного способа распознавания неоантигена мембраноатакующего комплекса, продуцируемого в результате активации системы комплемента. Скрининговое исследование применяется для обследования пациентов при подозрении на врожденный дефицит комплемента либо заболевания, протекающие с потреблением комплемента. С учетом результатов теста дальнейшее обследование пациента при подозрении на врожденный дефицит комплемента может быть нацелено на идентификацию вероятного дефицитного компонента (Таб. 1., раздел «Интерпретация»).
Литература
- Лапин С.В., Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. — СПб.: Изд. «Человек». 2010.
- Клиническое руководство Тица по лабораторным тестам (под ред. А. Ву). — М.: Изд. «Лабора». 2013:1280.
- Glovsky M.M. et al. Complement determinations in human disease. Annals of Allergy, Asthma, and Immunology. 2004;93:513-523.
- Nilsson B., Ekdahl K.N. Complement Diagnostics: Concepts, Indications, and Practical Guidelines. Clinical and Developmental Immunology. 2012;2012;11.
- Материалы фирмы-производителя реагентов.
Источник
Метод определения
Иммуноферментный анализ (ИФА).
Исследуемый материал
Сыворотка крови
Комбинированное выявление антител к ВИЧ типов 1 и 2 и антигена р24 ВИЧ, качественный тест.
Внимание. При положительных и сомнительных реакциях, срок выдачи результата может быть увеличен до 10-ти рабочих дней. ВИЧ (вирус иммунодефицита человека), вызывающий СПИД (синдром приобретенного иммунодефицита) — принадлежит к семейству ретровирусов. Передается от человека к человеку при использовании загрязненных игл и шприцев для внутривенного введения наркотиков или терапевтических процедур, при сексуальных контактах, как гетеро, так и гомосексуальных. Передача вируса может произойти при переливании инфицированной крови и ее продуктов, донорстве органов или семенной жидкости, у медицинских работников — при ранении инфицированными иглами или инструментами. Заражение ВИЧ возможно путем его передачи от инфицированной матери ребенку (вертикальный путь), хотя современные методы профилактики с применением антиретровирусной терапии, при выполнении всех рекомендаций, позволяют снизить такой риск до минимума.
В патогенезе заболевания основное значение имеет поражение CD4+ лимфоцитов (субпопуляция лимфоцитов, выполняющих важнейшие функции в регуляции и осуществлении иммунного ответа). Попадая в организм человека, ВИЧ поражает CD4+ лимфоциты, макрофаги и некоторые другие типы клеток. Присутствие ВИЧ со временем вызывает нарушение иммунной системы из-за избирательного уничтожения им иммунокомпетентных клеток. Это приводит к снижению иммунитета против вирусных, бактериальных, грибковых, протозойных, паразитарных, опухолевых заболеваний — развитию синдрома приобретенного иммунодефицита (СПИД). В соответствии со статистикой, раннее выявление инфекции и применение современной терапии значительно улучшают показатели выживаемости.
Процесс взаимодействия вируса с клеткой включает ряд стадий: связывание вируса с клеткой, освобождение его от оболочки, проникновение в цитоплазму, синтез ДНК по вирусной РНК, встраивание вирусной ДНК в геном клетки-хозяина. После этого начинается латентная стадия инфекции. В таком состоянии провирусная ДНК может существовать некоторое время, не проявляя активности и не влияя на жизнедеятельность клетки-хозяина. Пока нет экспрессии вирусных белков, нет и иммунного ответа на вирус. Антитела к ВИЧ, характеризующие иммунный ответ организма, появляются после активации вирусной ДНК и начала активного размножения вируса. Длительность латентного периода зависит от ряда факторов, включая и индивидуальные генетические особенности организма.
Антитела к ВИЧ могут появиться, начиная со второй недели после инфицирования; их содержание увеличивается в течение 2-4-х недель и сохраняется на протяжении многих лет. У 90-95% инфицированных они появляются в первые три месяца после заражения, у 5-9% – в период от трех до шести месяцев, у 0,5-1% – в более поздние сроки.
В первые недели инфекции, еще до появления антител к вирусу (т.е. до сероконверсии), в образцах сыворотки или плазмы можно выявить присутствие антигенов ВИЧ, в том числе его капсидного белка р24. Позже, после сероконверсии, он обычно становится недетектируемым.
Комбинированные тест-системы 4-го поколения, к которым относится тест HIV Ag/Ab Combo (Architect, Abbott), выявляют как антитела к ВИЧ 1 и 2 типов, так и антиген р24 ВИЧ, что позволяет проводить раннее обнаружение инфекции. К особым характеристикам применяемого в лаборатории ИНВИТРО скринингового теста для выявления ВИЧ-инфекции стоит отнести высокую специфичность исследования (> 99,5%); 100% чувствительность анализа к антителам, характерным для периода сероконверсии, и чувствительность теста к антигену р24 порядка 18 пг/мл.
Порядок проведения лабораторного обследования на ВИЧ строго регламентирован приказами МЗ РФ и включает в себя этап скринингового (отборочного) исследования наличия антител к ВИЧ иммуноферментными (ИФА) методами, разрешенными к использованию, и этап верификационного (подтверждающего) более развернутого исследования в лаборатории городского центра СПИД. Следует отметить, что даже лучшие скрининговые ИФА-системы не гарантируют 100% специфичности, то есть существует некоторая вероятность получения неспецифических, ложноположительных результатов, связанных с особенностями сыворотки крови пациента. Поэтому положительный результат скринингового ИФА обследования может не подтвердиться в подтверждающих тестах, после чего пациенту выдадут отрицательный или неопределенный результат. При неопределенном результате подтверждающего исследования тестирование следует повторить в динамике через 2-3 недели.
Лабораторная диагностика ВИЧ инфекции у детей, рожденных от ВИЧ-инфицированных матерей, имеет свои особенности. В их крови до 18-ти месяцев с момента рождения могут циркулировать материнские антитела к ВИЧ (класса IgG). Отсутствие антител к ВИЧ у новорожденных не означает, что вирус не проник через плацентарный барьер. Дети ВИЧ-инфицированных матерей подлежат лабораторно-диагностическому обследованию в течение 36-ти месяцев после рождения.
Источник
Метод определения
Флокуляционный (RPR-антиген, использующийся в наборах, является модификацией VDRL антигена).
Исследуемый материал
Сыворотка крови
Неспецифический антифосфолипидный (реагиновый) тест, современный аналог реакции Вассермана (RW), модификация VDRL (Venereal Disease Research Laboratory) теста.
RPR — скрининговый нетрепонемный тест, выявляющий антитела (реагины) класса IgG и IgM к липоидному и липопротеиноподобному материалу, высвобождаемому из повреждённых клеток больного сифилисом.
Тест RPR рекомендован приказом МЗ РФ для первичного скрининга и наблюдения за ходом лечения сифилиса.
Антифосфолипидные антитела, выявляемые этим тестом, находят у 70 — 80% лиц с первичным сифилисом и почти у 100% пациентов с вторичным и ранним латентным сифилисом. В большинстве случаев позитивная RPR-реакция наблюдается через 7 — 10 дней после появления первичного шанкра или через 3 — 5 недель после инфицирования. Титры снижаются после наступления вторичной стадии сифилиса. Около 30% пациентов с поздним сифилисом становятся нереактивными по RPR-тесту. Снижение титра RPR в 4 и более раз в течение 1 года после проведённой терапии подтверждает её эффективность. В 90 — 98% случаев после лечения сифилиса результат RPR-теста становится отрицательным.
Тест не является специфическим. Поэтому иногда возможно возникновение ложноположительных реакций. Антилипоидные антитела могут появляться не только вследствие сифилиса или других трепонемных инфекций, но и в ответ на развитие нетрепонемных заболеваний острой или хронической природы, при которых наблюдается повреждение тканей (особенно часто при аутоиммунных заболеваниях).
При получении положительного результата в RPR-тесте, пациент должен обследоваться дерматовенерологом с повторным исследованием крови с помощью специфического трепонемного диагностического теста (в лаборатории ИНВИТРО — тест № 70 сифилис ИФА, антитела к Treponema pallidum IgG/IgM, выявляющий специфические антитела к антигену Treponema pallidum).
Редкие ложноотрицательные результаты в реакции RPR (эффект «прозоны» при очень высоких титрах реагиновых антител) могут быть исключены одновременным назначением теста сифилис ИФА IgG/IgM. Эти два исследования являются взаимодополняющими; комбинированное использование тестов RPR и ИФА-теста IgG/IgM представляет лучший вариант скринингового исследования для обнаружения или исключения сифилиса на всех стадиях.
Особенности инфекции. Сифилис — хроническое инфекционное заболевание, характеризующееся мультисистемным поражением организма. Возбудитель сифилиса — Treponema pallidum — неустойчива в окружающей среде, но хорошо сохраняется во влажных биологических материалах (сперме, влагалищном секрете, слизи, гное и др.). Передаётся половым, парентеральным, бытовым, трансплацентарным путями. Увеличивают риск заражения другие инфекции, передающиеся половым путём: герпес, хламидиоз, папилломавирусная инфекция и др., а также повреждение слизистой оболочки при анальных контактах. Бледная трепонема имеет несколько антигенов, обусловливающих выработку антител. Один из них аналогичен кардиолипину, что позволяет использовать последний для обнаружения иммунитета к бледной трепонеме.
Заражение от больного человека возможно в любом периоде сифилиса. Наиболее инфекционными являются первичный и вторичный сифилис при наличии активных проявлений на коже и слизистых оболочках. Бледная трепонема проникает через микроповреждения кожи или слизистых в лимфатические сосуды, затем в лимфатические узлы. Далее возбудитель распространяется по органам и может определяться во всех биологических средах (слюне, грудном молоке, сперме и т.д.).
При классическом течении инкубационный период длится 3 — 4 недели, первичный серонегативный — 1 месяц, затем первичный серопозитивный — 1 месяц, затем вторичный период — 2 — 4 года, далее третичный период. В первичном периоде возникает твёрдый шанкр (безболезненная язва или эрозия с плотным дном в месте проникновения бледной трепонемы), сопровождающийся регионарным лимфангиитом и лимфаденитом. В конце первичного периода шанкр самостоятельно заживает, а лимфаденит переходит в полиаденит и сохраняется до пяти месяцев.
Первое генерализованное высыпание является признаком начала вторичного периода. Вторичные сифилиды появляются волнообразно (на 1,5 — 2 месяца каждая волна) и самостоятельно исчезают. Могут быть представлены пятнистыми, папулезными, пустулезными сифилидами, сифилитической аллопецией (облысением) и сифилитической лейкодермой («ожерелье Венеры»). На втором полугодии вторичного сифилиса исчезает полиаденит.
Появление третичных сифилидов (бугорков и гумм) знаменует начало третичного периода, который наступает у 40% нелеченных и неполноценно леченных больных. Волны третичного периода разделены более продолжительными (иногда многолетними) периодами латентного течения инфекции. В поражённых органах и тканях возникают деструктивные изменения. В третичных сифилидах содержится крайне мало трепонем, поэтому они практически не заразны. Напряжённость иммунитета падает (т. к. уменьшается количество бледных трепонем), поэтому становится возможным новое инфицирование (ресуперинфекция).
Передача сифилиса потомству наиболее вероятна в первые три года заболевания. В результате возникают поздние выкидыши (на 12 — 16 неделе), мертворождение, ранний и поздний врождённый сифилис. Поражение плода наиболее вероятно на 5-м месяце беременности и в родах. Проявления раннего врождённого сифилиса возникают сразу после рождения и аналогичны проявлениям вторичного сифилиса. Сифилиды позднего врождённого сифилиса возникают в возрасте 5 — 17 лет и аналогичны проявлениям третичного сифилиса. К безусловным признакам относится триада Гетчинсона (гетчинсоновские зубы, паренхиматозный кератит, лабиринтная глухота).
Диагноз сифилиса должен быть подтвержден лабораторными исследованиями, однако, в некоторых случаях может быть обоснован, несмотря на отрицательные результаты серологических реакций.
Особое значение лабораторная диагностика сифилиса имеет у следующих категорий обследуемых:
| Категория обследуемых | Причины |
| Женщины, при подготовке к беременности | 1. Возможно латентное течение или обезглавленный сифилис (сифилис без твердого шанкра, трансфузионный сифилис, когда трепонема попадает непостредственно в кровь при переливании крови, порезе) 2. Возможна бытовая или парентеральная передача |
| Беременные женщины | Проведение комплексной терапии в первые 4 месяца беременности позволяет избежать инфицирования плода |
Источник
Метод определения
Субпопуляции лимфоцитов – иммунофенотипирование (проточная цитофлюориметрия, безотмывочная технология).
Фагоцитарная активность — оценка фагоцитоза бактерий с флюоресцентной меткой.
Циркулирующие иммунные комплексы (ЦИК) — спектрофотометрия.
Иммуноглобулины A, M, G: иммунотурбидиметрия.
Иммуноглобулин E: хемилюминесцентный иммуноанализ.
Исследуемый материал
Цельная кровь с ЭДТА, цельная кровь с гепарином, сыворотка крови
Скрининговая оценка состояния различных звеньев иммунитета, используемая в диагностике первичных и вторичных иммунодефицитов, аутоиммунных, лимфопролиферативных, инфекционных, гематологических заболеваний.
В состав профиля входят следующие показатели:
- Лимфоциты , абсолютное значение
- Субпопуляции лимфоцитов:
- Т-лимфоциты (CD3+)
- Т-хелперы (CD3+CD4+)
- Т-цитотоксические лимфоциты (CD3+CD8+)
- Иммунорегуляторный индекс (CD3+CD4+/CD3+CD8+)
- В-лимфоциты (СD19+)
- ЕК-клетки (CD3-CD16+CD56+)
- Т-ЕК-клетки (CD3+CD16+CD56+)
- Активированные Т-лимфоциты (CD3+HLA-DR+)
- Активированные клетки, не относящиеся к Т-лимфоцитам (В-лимфоциты и активированные ЕК) (CD3-HLA-DR+)
- Т-лимфоцитов (CD3+CD69+)
- В- и ЕК-лимфоцитов (СD3-CD69+)
- Фагоцитоз (гранулоциты)
- Фагоцитоз (моноциты)
- IgG
- IgA
- IgM
- IgE
Основные субпопуляции лимфоцитов:
Т-лимфоциты – лимфоциты, созревание которых происходит в тимусе (отсюда их название). Они контролируют работу В-лимфоцитов, ответственных за образование антител, т. е. за гуморальный иммунный ответ.
Т-хелперы, Th (от англ. to help – помогать) – разновидность Т-лимфоцитов, несут на своей поверхности структуры, способствующие распознаванию антигенов, презентированных вспомогательными клетками, участвуют в регуляции иммунного ответа, вырабатывая различные цитокины.
Цитотоксические Т-клетки — распознают фрагменты антигена, на поверхности клеток-мишеней, ориентируют свои гранулы по направлению к мишени и высвобождают их содержимое в области контакта с ней. При этом некоторые цитокины являются сигналом гибели (по типу апоптоза) для клеток-мишеней.
В-лимфоциты (от лат. «bursa» — сумка по названию сумки Фабрициуса, в которой созревают эти лимфоциты у птиц) проходят развитие в лимфоузлах и других периферических органах лимфоидной системы. На поверхности эти клетки несут иммуноглобулины, функционирующие как рецепторы к антигенам. В ответ на взаимодействие с антигеном В-лимфоциты отвечают делением и дифференциацией в плазматические клетки, вырабатывающие антитела, посредством которых обеспечивается гуморальный иммунитет.
ЕК-клетки (естественные клетки-киллеры) или натуральные киллеры-клетки с естественной, неиммунной цитотоксической активностью к неопластически изменённым клеткам-мишеням, которые не относятся ни к зрелым Т- или В-лимфоцитам, ни к моноцитам.
Т-ЕК-клетки (ЕКТ) – клетки с естественной неиммунной киллерной активностью, имеющие признаки Т-лимфоцитов.
Активированные лимфоциты.
HLA-DR – один из антигенов MHC класса II (major histocompatibility complex — главный комплекс гистосовместимости), участвующих в презентации потенциально чужеродных антигенов, что необходимо для формирования адекватного иммунного ответа. При иммунофенотипировании может быть использован в качестве маркёра активированных клеток. CD3+HLA-DR+ — клетки, представляющие собой зрелые активированные Т-лимфоциты человека. CD3-HLA-DR+ — активированные клетки, не относящиеся к Т-лимфоцитам (В-лимфоциты и активированные ЕК).
Способность лимфоцитов к активации.
Способность лимфоцитов к активации в данном тесте оценивают по содержанию лимфоцитов, экспрессирующих CD69 в ответ на инкубацию в присутствии ФГА (митоген растительного происхождения). CD69 (другие названия — activation inducer molecule, AIM; early activation antigen, EA-1) – ранний маркёр активации, трансмембранный белок типа I. Этот белок вовлечен в ранние механизмы активации Т-клеток, ЕК-клеток, В-клеток, моноцитов и тромбоцитов.
Фагоцитарная активность лейкоцитов.
Данные по фагоцитарной активности нейтрофилов и моноцитов (относительное содержание клеток, фагоцитировавших добавленные к пробе при инкубации меченые флюоресцентной меткой бактерии) позволяют оценить резервные возможности этих клеток по поглощению и перевариванию чужеродных агентов.
Циркулирующие иммунные комплексы общие (ЦИК)
Одновременное присутствие высоких концентраций антигенов и их специфических антител может вести к образованию циркулирующих иммунных комплексов. Иммунные комплексы могут выходить из кровотока в мелких сосудах и откладываться в тканях, например, в гломерулах почек, в лёгких, коже, суставах, стенке сосудов. ЦИК обладают способностью связывать и активировать комплемент, что ведёт к повреждению ткани. Повышение уровня ЦИК может наблюдаться при аутоиммунных заболеваниях, хронических инфекционных заболеваниях, при которых постоянная продукция антигена инфекционным агентом сочетается с иммунным ответом на него (хронические гепатиты). Клинически это часто проявляется гломерулонефритами, артритами, нейропатиями. Несмотря на непосредственную роль в патогенезе некоторых заболеваний, определение ЦИК не всегда информативно, поскольку количество иммунных комплексов, отложившихся в тканях более важно, чем количество комплексов, циркулирующих в крови. Исследование ЦИК может быть недостаточно чувствительным и специфичным в диагностике болезней, вызываемых иммунными комплексами, и должно дополняться исследованием эффектов ЦИК на функцию органов (например, концентрация креатинина и анализ мочи), а также определением С3 С4 компонентов комплемента (см. тест
№ 193
), количество которых снижается вследствие усиленного потребления.
Данные иммунологического исследования интерпретирует врач-иммунолог в комплексе со всеми клинико-анамнестическими данными конкретного пациента. При оценке иммунного статуса пациента результаты исследования оценивают с точки зрения природы и стадии патологического процесса, сопутствующих заболеваний, приёма лекарственных препаратов и пр. При этом важны не только абсолютные значения отдельных показателей, но и их соотношение и динамика показателей. Изменения иммунологических показателей могут быть проявлением нормальной реакции организма на воздействие физиологических или патологических факторов (с различной картиной сдвигов на разных стадиях заболевания), отражать чрезмерную активацию, истощение иммунной системы, характеризовать врождённый или приобретённый дефект отдельных звеньев иммунной системы.
Литература
- Зурочка А.В., Хайдуков С.В. и др. — Проточная цитометрия в медицине и биологии. – Екатеринбург: РИО УрО РАН, 2013. – 552 с.
- Клиническая иммунология и аллергология / Ред. Лолор-младший Г., Фишер Т, Д. Адельман Д../: Пер. с англ. — М.: Практика, 2000. — 806 с.
- Клиническая лабораторная диагностика. Национальное руководство. Том 2./Ред. Долгов В.В., Меньшиков В.В./ – М., ГЭОТАР-Медиа, 2012 – 808 с.
- Практическое руководство по детским болезням. Том 8 Иммунология детского возраста. /Ред. А.Ю.Щербина, Е.Д.Пашанов/ — Москва: МЕДПРАКТИКА, 2006 — 432 с.
- Ройт А., Бростофф Д., Дейл Д. Иммунология. — М.: Мир, 2000 — 592 с
- Ярилин А. А. Иммунология. – М.: ГЭОТАР-Медиа. 2010 — 752 с.
- Leach М., Drummond М., Doig A. Practical Flow Cytometry in Haematology Diagnosis Hardcover. – WILEY-BLACKWELL, 2013.
- Tietz Clinical guide to laboratory tests. 4-th ed. Ed. Wu A.N.B. – USA: W.B Sounders Company, 2006 — 1798 p.
Источник

