Анализ крови bcr abl что это
Метод определения
Полимеразная цепная реакция (ПЦР)
Исследуемый материал
Цельная кровь
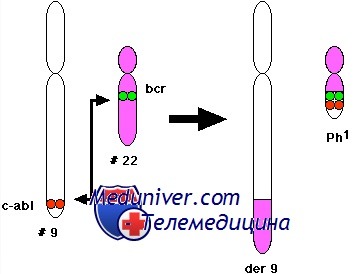
Ген BCR-ABL – химерный ген, образованный частями двух генов: BCR (22q11) и ABL (9q34.1) в результате обмена генетическим материалом между 22-й и 9-й хромосомами – реципрокной транслокации t(9;22)(q34;q11). Экспрессируется как единое целое с образованием патологического белка, обладающего многократно большей тирозинкиназной активностью, чем нормальный предшественник – тирозинкиназа ABL. Следствием такой трансформации является конститутивное (не зависящее от действия цитокинов) усиление роста и размножения клеток с блокированием их апоптоза.
Обнаружение транскрипта гена BCR-ABL является высокоспецифичным диагностическим маркером хронического миелоидного лейкоза (ХМЛ). Кроме того, транслокацию t(9;22)(q34;q11) с образованием гена BCR-ABL обнаруживают при остром лимфобластном лейкозе (ОЛЛ) (15-30% случаев ОЛЛ у взрослых и 2-10% – у детей), а также при остром миелобластном лейкозе (редко).
В зависимости от положения точки разрыва хромосом при транслокации t(9;22)(q34;q11) могут образовываться различные варианты транскрипта, продуцируемого с гена BCR-ABL. Белок BCR-ABL при этом может иметь молекулярную массу 190, 210 и 230 килодальтон и обозначается р190, р210, соответственно. У подавляющего большинства пациентов с ХМЛ (свыше 95%) обнаруживается белок р210. При этом наиболее частыми являются варианты транскрипта b3a2 (50% случаев) и b2a2 (45% случаев). У малого числа больных определяют варианты b3a3 и b2a3. Белок р190 (варианты е1а2 (более 95% случаев) и е1а3 (редко)) характерен для ОЛЛ, но может присутствовать у больных ХМЛ с BCR-ABL р210 как продукт альтернативного сплайсинга. В крайне небольшом количестве случаев ХМЛ образуется белок р230 (варианты е19а2 и е19а3).
Методы генетической диагностики онкогематологических заболеваний
Литература
- Абдулкадыров К.М. Клиническая гематология: справочник. — СПб.: Изд. «Питер Принт». 2006:447.
- Абдулкадыров К.М. Миелопролиферативные новообразования. — М.: Изд. «Литтерра». 2016:304.
- Chasseriau J., Rivet J., Bilan F. et al. Characterization of the different BCR-ABL transcripts with a single multiplex RT-PCR. Journal of molecular diagnostics. 2004;6(4):343-347.
- Arber D.A., Orazi A., Hasserjian R. et al. The 2016 revision of the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016;127(20):2391-2405.
специальной подготовки не требуется.
- диагностика хронического миелоидного лейкоза, острого лимфобластного лейкоза.
- мониторинг терапии и минимальной остаточной болезни.
Интерпретация результатов
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Форма выдачи результата: качественный анализ.
Примеры результатов:
Ген BCR-ABL (р190) (t(9;22)) — не обнаружен;
Ген BCR-ABL (р210) (t(9;22))– обнаружен (вариант b3a2).
Артикул:
777732
Срок исполнения:
до 9 рабочих дней ?
Указанный срок не включает день взятия биоматериала
Цена:
1 790 руб
Взятие крови из вены:
- + 200 руб
В этом разделе вы можете узнать, сколько стоит выполнение данного исследования в вашем городе, ознакомиться с описанием теста и таблицей интерпретации результатов. Выбирая, где сдать анализ «Анализ химерного гена BCR/ABL — t(9;22), определение типа транскрипта BCR/ABL гена — ПЦР, качеств. » в Москве и других городах России, не забывайте, что цена анализа, стоимость процедуры взятия биоматериала, методы и сроки выполнения исследований в региональных медицинских офисах могут отличаться.
Источник
[18-093]
Хронический миелолейкоз. FISH анализ химерного гена BCR/ABL
10805 руб.
Метод молекулярно-генетической диагностики хронического миелолейкоза, позволяющий выявить в генетическом материале клеток крови или костного мозга мутантный ген, продукт деятельности которого играет ключевую роль в развитии этого заболевания.
Синонимы русские
Исследование клеток крови методом FISH (t (9; 22)/BCR/ABL), FISH анализ транслокации t(9;22) BCR-ABL.
Синонимы английские
BCR/ABL1 Translocation (9;22), FISH; Philadelphia Chromosome, BCR-ABL1 Fusion.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Специальной подготовки не требуется.
Общая информация об исследовании
Хронический миелолейкоз является опухолевым заболеванием кроветворной системы, в результате которого в периферической крови наблюдается повышение уровня определенного вида лейкоцитов. Развитие заболевания связано с возникновением в стволовой клетке крови генетической аномалии, которая получила название филадельфийской хромосомы. У человека на девятой хромосоме локализуется ген ABL, который кодирует образование белка, стимулирующего рост и деление клеток. При хроническом миелолейкозе часть гена ABL перемещается на хромосому 22, такая мутация называется транслокацией. Место разрыва двадцать второй хромосомы, куда чаще всего встраивается перемещенная часть гена ABL, называется M-bcr (от английского major breakpoint claster region). В норме в этом участке хромосомы расположен ген BCR, кодирующий белок, функция которого в настоящее время достоверно не изучена, однако есть сведения, что он участвует в процессах деления и дифференцировки клеток. В результате транслокации на 22-й хромосоме образуется сливной, или химерный, ген BCR-ABL, при считывании информации с которого продуцируется белок р210. От части гена ABL этот белок получает способности тирозинкиназы – внутриклеточного фермента, участвующего в передаче сигналов пролиферации, а часть, кодируемая геном BCR, способствует его активации. Таким образом, в результате описанной мутации на 22-й хромосоме формируется ген, белковый продукт которого – тирозинкиназа с повышенной активностью — активирует деление клеток с полной независимостью от внешних регуляторных механизмов. Лейкозные клетки становятся нечувствительными к сигналам самоуничтожения, приобретают способность выходить из костного мозга в периферическую кровь, не дожидаясь созревания. Обнаружение филадельфийской хромосомы, гена BCR-ABL или его белкового продукта являются основными способами диагностики хронического миелолейкоза.
Наличие филадельфийской хромосомы исследуют в клетках периферической крови или костного мозга. При использовании крови её взятие производят обычным способом – посредством пункции вены и набора необходимого количества крови в вакутейнер. Взятие костного мозга проходит под местной анестезией, поэтому, если имеется аллергия на какой-либо местный анестетик, необходимо обязательно сообщить об этом доктору. После наступления анестезии врач специальной иглой производит пункцию кости (обычно из грудины или гребней подвздошных костей), шприцем аспирирует костный мозг и перемещает его в пробирку. Несмотря на анестезию, непосредственно в момент аспирации могут возникать болевые ощущения из-за перепада давления в полости кости. После манипуляции на место пункции накладывают асептическую повязку.
Стандартным методом для обнаружения описанной хромосомной аномалии является цитогенетическое исследование клеток костного мозга, однако оно не всегда позволяет выявить филадельфийскую хромосому, и в таких случаях рекомендуется более чувствительный анализ – FISH. Флюоресцентная in-situ гибридизация является молекулярно-генетическим исследованием, которое позволяет выявить в генетическом материале анализируемых клеток последовательность нуклеотидов, характерную для химерного гена BCR-ABL. Для этого применяются специальные последовательности ДНК, аналогичные участкам нормальных генов ABL и BCR, меченные флюоресцирующими веществами разных цветов – ДНК-зонды. В процессе анализа под воздействием высокой температуры и химических веществ двухцепочечные молекулы ДНК разделяются на отдельные цепи. Следующим этапом происходит гибридизация – соединение цепочек зондов с подходящими участками на клеточной ДНК. Результат гибридизации врач оценивает с помощью флюоресцентного микроскопа, который позволяет увидеть свечение, испускаемое присоединившимися к нативной ДНК зондами. При отсутствии транслокации каждый зонд присоединится к своей хромосоме и в микроскоп будут видны два разных и удаленных друг от друга свечения. Химерный ген BCR-ABL на 22-й хромосоме присоединит к себе оба зонда, и в микроскопе свечение будет исходить из одной точки, а его цвет поменяется на соответствующий комбинации двух исходных.
Для чего используется исследование?
- Для выявления мутантного гена BCR-ABL при первичной диагностике хронического миелолейкоза, а также в процессе лабораторного мониторинга эффективности терапии и прогрессирования заболевания.
Когда назначается исследование?
При отсутствии филадельфийской хромосомы по данным стандартного цитогенетического исследования или его недоступности:
- при первичной диагностике хронического миелолейкоза;
- через 3 и 6 месяцев от начала терапии ингибитором тирозинкиназ – для оценки ответа предпочтительнее проводить молекулярное исследование (ПЦР), однако при его недоступности допускается выполнение FISH;
- через 12 месяцев от начала терапии ИТК – если по результатам ПЦР не достигнут полный цитогенетический или большой молекулярный ответ;
- всегда при неудаче лечения;
- при появлении клинических или лабораторных признаков прогрессирования заболевания.
Дифференциально-диагностические критерии уровней ответа на терапию ингибиторами тирозинкиназ, а также их интерпретация в качестве оптимального результата или неудачи лечения рассматриваются по утвержденным единым международным рекомендациям.
Что означают результаты?
Помимо исследования наличия BCR-ABL в анализируемом материале, при обнаружении химерного гена указывается, в какой доле проанализированных клеток он выявлен, исходя из чего определяется уровень достигнутого ответа (однако необходим анализ не менее 200 ядер):
более 95% — отсутствие цитогенетического ответа;
65-95% — минимальный цитогенетический ответ;
36-65% — малый цитогенетический ответ;
≤ 35% — частичный цитогенетический ответ;
0% — полный цитогенетический ответ.
Частичный и полный цитогенетические ответы соответствуют выраженному снижению Ph-позитивных клеток и определяются как большой цитогенетический ответ.
Что может влиять на результат?
Нарушения в проведении отдельных этапов исследования, опыт и квалификация врача молекулярно-генетической диагностики.
Важные замечания
- Последние рекомендации NCCN (National Comprehensive Cancer Network, США) допускают использование FISH в целях мониторинга ответа на терапию ингибиторами тирозинкиназ только при недоступности стандартного цитогенетического исследования или количественной полимеразной цепной реакции.
- Целесообразность выполнения данного исследования, особенно в целях мониторинга ответа на проводимую терапию ингибиторами тирозинкиназ, необходимо согласовывать с лечащим врачом-гематологом. Равно как и интерпретация полученных результатов и принятие решения о продолжении или смене таргетного препарата должны проводиться исключительно доктором.
- Если для взятия биоматериала для исследования предполагается проведение пункции костного мозга, необходимо предупредить врача о приеме каких-либо лекарств, влияющих на свертываемость крови.
Также рекомендуется
Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с обязательной микроскопией мазка крови)
Морфологическое исследование трепанобиоптата костного мозга
Мочевая кислота в сыворотке
Лактатдегидрогеназа (ЛДГ) общая
Кто назначает исследование?
Гематолог, онколог, терапевт, врач общей практики.
Литература
- Wintrobe’s clinical hematology / editors, John P. Greer, Daniel A. Arber, Bertil Glader, Alan F. List, Robert T. Means Jr., Frixos Paraskevas, George M. Rodgers. – 13th edition. Lippincott Williams & Wilkins, 2014. Pages 1711-1712.
NCCN Clinical Practice Guidelines in Oncology: Chronic Myeloid Leukemia. Version 4.2018 – January 24, 2018. Available at www.nccn.org.
Гематология: национальное руководство / под ред. О. А. Рукавицына. — М. : ГЭОТАР-Медиа, 2015. С. 381-398.
Источник
Хронический миелоидный лейкоз (ХМЛ): причины, диагностика, лечениеЭтиология и встречаемость хронического миелоидного лейкоза (ХМЛ). Хронический миелоидный лейкоз (ХМЛ) (MIM №608232) — клональная экспансия трансформированных кроветворных клеток-предшественниц, при которой возрастает число циркулирующих миелоидных клеток. Трансформация клеток-предшественниц происходит за счет экспрессии онкогена BCR-ABL. Хронический миелоидный лейкоз (ХМЛ) составляет до 15% всех случаев лейкоза у взрослых и встречается с частотой 1-2 на 100 000; скорректированная возрастная встречаемость более высокая среди мужчин, чем среди женщин (1,3-1,7 против 1,0). Патогенез хронического миелоидного лейкоза (ХМЛ)Приблизительно 95% пациентов с хроническим миелоидным лейкозом (ХМЛ) имеют филадельфийскую хромосому; остальные — сложные варианты транслокаций. Протоонкоген Абельсона (ABL), кодирующий нерецепторную тирозинкиназу, находится в сегменте 9q34, а ген точечного разрыва кластерного региона (BCR), кодирующий фосфопротеин, — в 22qll. При образовании филадельфийской хромосомы ген ABL разрывается в интроне 1, а ген BCR в одном из трех кластерных регионов разрыва; в производной хромосоме 22 фрагменты генов BCR и ABL соединяются «голова в хвост». Объединенный ген BCR-ABL в транслоцированной хромосоме 22 генерирует белок, изменяющийся по величине в зависимости от длины пептида Bcr, присоединяющегося к N-концу. До настоящего времени функции белков Abl и Bcr в норме окончательно не определены. Белок Abl довольно хорошо сохраняется в ходе эволюции многоклеточных. Он присутствует как в ядре, так и в цитоплазме и связан с внутренней цитоплазматической мембраной. Относительное количество белка Abl в этих частях клетки изменяется в различных типах клеток, а также в ответ на стимулы. Abl участвует в клеточном цикле, ответе на стресс, передаче сигналов от интегринов и в нервном развитии. Функциональные области Bcr включают двойную спираль для полимеризации с другими белками, область треонин-серин-киназы, область обмена ГДФ-ГТФ, вовлеченную в регуляцию белков семейства Ras, и область активации ГТФ, участвующую в регуляции Rac и Rho ГТФаз.
Экспрессия Abl не приводит к трансформации клеток, вызываемой экспрессией химерного белка Bcr-Abl. У трансгенных мышей, вырабатывающих химерный Bcr-Abl с рождения, развивается острый лейкоз, а инфицирование здоровых мышей ретровирусами, экспрессирующими Bcr-Abl, вызывает ряд острых и хронических лейкозов, в зависимости от генетического фона. В отличие от белка Abl, химерный белок Bcr-Abl имеет активность конститутивной тирозинкиназы и ограничен цитоплазмой, где энергично связывает микрофибриллы актина. Bcr-Abl фосфорилирует несколько цитоплазматических субстратов и тем самым активизирует сигнальные каскады, управляющие ростом, дифференцировкой и, возможно, адгезией кроветворных клеток. Неправильная активизация этого сигнального пути приводит к неуправляемому распространению гемопоэтических стволовых клеток, выходу незрелых клеток из костного мозга, и, в конце концов, к хроническому миелоидному лейкозу (ХМЛ). По мере развития хронического миелоидного лейкоза (ХМЛ) становится все более агрессивным. В ходе этой эволюции клетки опухоли у 50-80% пациентов приобретают дополнительные хромосомные изменения [трисомию 8,i(17q), или трисомию 19], вторую филадельфийскую хромосому. Кроме описанных цитогенетических изменений, при развитии хронического миелоидного лейкоза (ХМЛ) также часто мутируют гены-супрессоры опухолевого роста и протоонкогены. Фенотип и развитие хронического миелоидного лейкоза (ХМЛ)Хронический миелоидный лейкоз (ХМЛ) — двух- или трехфазная болезнь. Начальный, или хронический этап характеризуется незаметно подкрадывающимся началом с постепенным развитием усталости, недомогания, потери массы тела и минимальным или умеренным увеличением селезенки. Со временем хронический миелоидный лейкоз (ХМЛ) обычно переходит в фазу акселерации и затем в бластный криз, хотя некоторые пациенты переходят непосредственно от хронической фазы в бластный криз. Развитие хронического миелоидного лейкоза (ХМЛ) включает появление дополнительных хромосомных аномалий в клетках опухоли, прогрессирующего лейкоцитоза, анемии, тромбоцитоза или тромбоцитопении, всевозрастающую спленомегалию, лихорадку и костные нарушения. Властный криз — состояние острого лейкоза, бласты могут быть миелоидными, лимфоидными, эритроидными или недифференцированными. Фаза акселерации — промежуточная между хронической фазой и бластным кризом. Приблизительно 85% больных диагностируют в хронической фазе. В зависимости от метода исследования, средний возраст постановки диагноза колеблется от 45 до 65 лет, хотя заболеванию подвержены лица любых возрастов. При отсутствии лечения показатель перехода из хронической фазы в бластный криз составляет приблизительно 5-10% в первые 2 года и затем 20% за год. Поскольку бластный криз быстро приводит к летальному исходу, развитие криза равнозначно смерти. Особенности фенотипических проявлений хронического миелоидного лейкоза (ХМЛ):
Лечение хронического миелоидного лейкоза (ХМЛ)Выяснение молекулярной основы хронического миелоидного лейкоза (ХМЛ) привело к разработке специфического ингибитора тирозинкиназы Bcr-Abl — иматиниба (гливек). Теперь это лекарство — основной препарат при лечении хронического миелоидного лейкоза (ХМЛ). Более 85% больных дают четкий цитогенетический ответ на терапию иматинибом, с исчезновением t(9;22) в клетках, получаемых при пункции костного мозга. Цитогенетический ответ соответствует значительному уменьшению тяжести хронического миелоидного лейкоза (ХМЛ) до уровня ниже 109-1010 лейкемоидных клеток. Тем не менее только у некоторых пациентов (<5%) химерный ген BCR-ABL не выявляется при ПЦР, указывая, что даже в стадии ремиссии большинство пациентов имеет остаточные признаки лейкоза от 106 до 107 клеток. Более 95% пациентов с полной гематологической и цитогенетической ремиссией остаются бессимптомными более 3,5 лет. Пациенты в фазе бластного криза также показывают улучшение 12-месячной выживаемости до 32%, но часто снова впадают в криз. У этих пациентов часто (60-90%) отмечают устойчивость к иматинибу, что связано с точковыми мутациями, вызывающими резистентность Abl-киназы к лекарству или, реже, с амплификацией гена BCR-ABL. Хотя единственная известная терапия — аллогенная пересадка костного мозга, успех применения иматиниба ограничил число лиц, кому предлагают эту операцию, только теми, у кого шансы на удачу наибольшие (пациенты моложе 40 лет с HLA-совместимым донором, у которых успех пересадки приближается к 80%) и находящимися в состоянии бластного криза. Успех пересадки костного мозга зависит от стадии хронического миелоидного лейкоза (ХМЛ), возраста и общего здоровья больного, отношения к донору костного мозга (родственный против неродственного), подготовительного режима, развития реакции «трансплантат против хозяина», и лечения после пересадки. Большинство случаев продолжительного успеха пересадки костного мозга зависит от эффекта «трансплантат против лейкоза», т.е. когда ответ «трансплантат против хозяина» направлен против лейкемических клеток. После пересадки костного мозга больных необходимо часто проверять методом ПЦР с обратной транскриптазой на наличие копий гена BCR-ABL и, при необходимости, назначать лечение. Если пересадка оказывается неудачной, пациенты часто отвечают на введение донорских Т-клеток, соответствующее механизму действия пересадки клеток костного мозга. Пациенты в фазе бластного криза обычно получают иматиниб, цитостатики и, если возможно, пересадку костного мозга. К сожалению, только 30% пациентов имеют соответствующего HLA-совместимого донора костного мозга. Результаты терапии в фазе бластного криза остаются неудовлетворительными. Риски наследования хронического миелоидного лейкоза (ХМЛ)Поскольку хронический миелоидный лейкоз (ХМЛ) возникает вследствие соматической мутации, не обнаруживаемой в половых клетках, риск передать болезнь детям равен нулю. Пример хронического миелоидного лейкоза (ХМЛ). Е.С., 47-летняя женщина, обратилась к семейному врачу для ежегодного обследования. У нее было хорошее здоровье, специфических жалоб не предъявляла. При осмотре пальпаторно выявлено увеличение селезенки, и больше никаких других аномальных признаков. Результаты развернутого анализа крови неожиданно показали повышение числа лейкоцитов до 31х109/л и тромбоцитов до 650х109/л. В мазке периферической крови выявлены базофилия и незрелые гранулоциты. Для дальнейшего обследования врач направил пациентку в онкологическое отделение. В костном мозге оказалось увеличенное число миелоидных и мегакариоцитарных клеток с повышенным соотношением между миелоидными и эритроидными клетками. Цитогенетический анализ костного мозга идентифицировал несколько миелоидных клеток с филадельфийской хромосомой, der(22)t(9;22)(q34;qll.2). Онколог объяснил, что у больной хронический миелоидный лейкоз (ХМЛ), хотя вялотекущий в настоящий момент, но имеющий высокий риск перейти в угрожающий жизни лейкоз в последующие несколько лет. Ей также сообщили, что хотя единственный доступный в настоящее время потенциально излечивающий метод терапии — пересадка донорского костного мозга, недавно разработанная лекарственная терапия, нацеленная на онкоген хронического миелоидного лейкоза (ХМЛ), может вызвать или поддержать продолжительную ремиссию. — Также рекомендуем «Болезни Крона: причины, диагностика, лечение» Оглавление темы «Наследственные болезни»:
|
Источник