Забор крови на общий анализ техника

В лабораторной практике используют капиллярную кровь,
которую получают путем укола в мякоть боковой поверхности 4-го
пальца левой руки или мочки уха, или венозную кровь из локте-
вой вены ( при работе на автоанализаторах). Для забора крови
используют иглы-скорификаторы, которые после употребления моют
и кипятят в стерилизаторе или помещают на 2 часа в сушильный
шкаф при температуре 180 С.
1.Кровь для планового анализа следует брать утром натощак
или через 1 час после легкого завтрака.Не рекомендуется брать
кровь сразу после физической или умственной нагрузки,паренте-
рального введения медикаментов, физиотерапевтических процедур,
рентгенологического исследования и т.д. Так, нервное напряже-
ние , эмоциональные перегрузки ведут к развитию кратковремен-
ного нейтрофильного лейкоцитоза без существенного омоложения
состава лейкоцитов. Несколько повышает уровень лейкоцитов в
крови прием пищи. Аналогичный эффект вызывается введением ад-
реналина. В основе этой реакции лежит преимущественно мобили-
зация сосудистого гранулоцитарного резерва. При этом лейкоци-
тоз в течение нескольких десятков минут. Медиаторы (норадрена-
лин, ацетилхолин) влияют на кроветворную систему, не только
вызывая перераспределение крови, но и путем прямого воз-
действия на стволовые клетки, в которых имеются адрено- и хо-
линорецепторы.Лейкоцитоз с палочкоядерным сдвигом вызывается
введением пирогенола и глюкокортикоидных стероидных гормонов,
достигая максимума через 2-6 часов и обусловлен выходом грану-
лоцитов из костномозгового резерва. Содержание гранулоцитов в
костномозговом резерве превышает их количество в кровеносном
русле в 30-50 раз. Такие гормоны как андрогены, стимулируют
эритропоэз,мобилизируя эндогенный эритропоэтин.
Повторные исследования следует проводить в одни и те же
часы, поскольку морфологический состав крови подвержен колеба-
ниям на протяжении суток.
2. Кожу на месте укола протирают ватным тампоном, смочен-
ным сначала 70 спиртом, затем эфиром.Укол лучше производить
сбоку, где более густая капиллярная сеть, на глубину 2-3 мм в
зависимости от толщины кожи.Кровь из ранки должна вытекать
свободно, т.к. при сильном надавливании на палец возможно при-
мешивание тканевой жидкости, что приводит к искажению резуль-
тата.
3. Затем сухим тампоном удаляется первая капля крови.
4. Не прикасаясь к раневой поверхности , с помощью пере-
ходника и резиновой груши наполнить кровью капилляр до метки.
5. Новым стерильным тампоном, смоченным 70 спиртом, обро-
ботать раневую поверхность пальца.
Перед каждым забором крови лаборант моет руки под проточ-
ной водой с мылом или обрабатывает их стерильным тампоном,
смоченным 70 спиртом.
ОСНОВНЫЕ ПОЛОЖЕНИЯ ПРИКАЗА МЗ РБ N 66 от 2 апреля 1993
«О МЕРАХ ПО СНИЖЕНИЮ ЗАБОЛЕВАЕМОСТИ ВИРУСНЫМИ ГЕПАТИТАМИ В РБ»
При манипуляциях, лабораторных исследованиях с возможным
попаданием на медицинского работника крови или других биологи-
ческих жидкостей используются средства индивидуальной защи-
ты:обязательны халат хирургического типа, резиновые перчат-
ки, очки, маска (или щиток).
Любое повреждение кожи, слизистых,забрызгивание их кровью
или другой биологической жидкостью пациента при оказании им
медицинской помощи должно квалифицироваться как возможный кон-
такт с материалом, содержащим ВИЧ или другой агент инфекцион-
ного заболевания.
Если контакт с кровью или другой биологической жидкостью
произошел с нарушением целостности кожных покровов (укол, по-
рез), пострадавший должен:
— быстро снять перчатки рабочей поверхностью внутрь;
— сразу же выдавить из раны кровь;
— поврежденное место обеззаразить одним из дезинфицирую-
щих растворов (70 спирт, 5% настойка иода при порезах, 3%
раствор перекиси водорода при уколах и др.);
— руки вымыть под проточной водой с мылом и затем проте-
реть спиртом;
— на рану наложить пластырь, надеть напальчник;
— при необходимости продолжить работу надеть новые пер-
чатки;
В случае загрязнения кровью или другой био.жидкостью без
повреждения кожи:
— обработать кожу спиртом, а при его отсутствии 3% раст-
вором перекиси водорода, 3% р-ром хлорамина или другими
дез.растворами;
— промыть место загрязнения водой с мылом и повторно об-
работать спиртом.
При попадании био.материала на слизистые оболочки:
— полости рта: прополоскать 70 спиртом;
— полости носа: закапать 30% р-р альбуцида из тюбика-ка-
пельницы;
— глаза: промыть водой (чистыми руками), закапать
несколько капель 30% р-ра альбуцида из тюбика-капельницы.
При отсутствии 30% р-ра альбуцида для обработки слизистых
оболочек носа и глаз можно использовать 0.05% р-р марганцево-
кислого калия
При попадании био.материала на халат, одежду:
— это место немедленно обработать одним из дез. растворов.
При промакании одежды и/или ее массивном загрязнении :
— обеззараживаются перчатки;
— далее одежда снимается и замачивается одном из
дез.растворов ( кроме 6% перекиси водорода, нейтрального ги-
похлорита Са, которые разрушают ткани) или помещается в полиэ-
тиленовый пакет для автоклавирования;
— кожа рук и других участков тела под местом загрязнения
одежды протирается 70 спиртом, затем следует промыть водой с
мылом и повторно протереть спиртом.
(Visited 280 times, 1 visits today)
Источник
Медицинская сестра
накануне исследования должна предупредить
больного о предстоящем заборе крови и
разъяснить, что кровь берут натощак, до
приёма лекарственных средств, а на ужин
не следует употреблять жирную пищу.
При заборе крови
из вены время наложения жгута должно
быть по возможности минимальным, так
как длительный стаз крови повышает
содержание общего белка и его фракций,
кальция, калия и других компонентов.
В зависимости от
цели исследования забор крови для
лабораторного анализа осуществляют из
пальца (капиллярная кровь) и из вены
(венозная кровь).
Кровь из пальца
берёт лаборант. Этот анализ необходим
для количественного и качественного
изучения форменных элементов крови
(эритроцитов, лейкоцитов, тромбоцитов),
определения количества в крови гемоглобина
и скорости оседания эритроцитов (СОЭ).
Такой анализ называют общим
анализом крови.
Кроме того, в ряде
случаев из пальца
берут кровь для определения содержания
в крови глюкозы, а также свёртываемости
крови и времени кровотечения.
В настоящее время
созданы аппараты (например, «Холестех»,
США), в которых на основе восковой матрицы
осуществляется возможность из капли
крови, взятой из пальца, определять
содержание в крови общего холестерина,
холестерина липопротеидов высокой,
низкой и очень низкой плотности,
триглицеридов и глюкозы, рассчитывать
индекс атерогенности и риск развития
ИБС.
Кровь из вены
берёт процедурная медицинская сестра
посредством пункции в большинстве
случаев локтевой вены; кровь смешивается
в пробирке с противосвёртывающим
веществом (гепарин, натрия цитрат). Забор
крови из вены осуществляют с целью
количественного изучения биохимических
показателей крови (так называемых
печёночных проб, ревматологических
проб, содержания глюкозы, фибриногена,
мочевины, креатинина), обнаружения
возбудителей инфекции (взятие крови на
гемокультуру и определение чувствительности
к антибиотикам) и антител к ВИЧ. Объём
забираемой из вены крови зависит от
количества определяемых компонентов
— обычно из расчёта 1-2 мл на каждый вид
анализа.
Взятие крови на
исследование из вены
Противопоказания
к процедуре определяет врач. К ним
относят крайне тяжёлое состояние
пациента, спавшиеся вены, судороги,
возбуждённое состояние пациента.
Весь использованный
во время манипуляции материал необходимо
продезинфицировать.
Резиновый жгут и
клеёнчатый валик протирают дважды
ветошью, смоченной дезинфицирующим
раствором (например, 3% раствором хлорамина
Б), и промывают проточной водой.
Использованный ватный шарик с кровью
обязательно следует забрать у пациента
и, прежде чем поместить его в отходы,
замочить в дезинфицирующем растворе
не менее чем на 60 мин. Дезинфицирующим
раствором необходимо обработать также
и рабочий стол.
Необходимое
оснащение:
• одноразовые
(стерильные) шприцы с иглами;
• стерильный лоток
с ватными шариками и пинцетом;
• резиновый жгут,
резиновый валик и салфетка;
• 70% раствор спирта,
чистые пробирки с пробочками в штативе;
• спецодежда
(халат, маска, стерильные перчатки);
• лоток для
использованного материала;
• тонометр,
фонендоскоп, противошоковый набор
лекарственных средств.
Порядок выполнения
процедуры:
1. Подготовить
пациента — помочь ему занять удобное
положение сидя или лёжа.
2. Подготовиться
к процедуре: пронумеровать пробирку и
направление на анализ (одина-
ковым порядковым
номером), вымыть и высушить руки, надеть
спецодежду, обработать руки ватными
шариками, смоченными 70% раствором спирта,
надеть перчатки.
3. Подложить под
локоть пациента клеёнчатый валик для
максимального разгибания локтевого
сустава.
4. Освободить от
одежды руку или поднять рукав рубашки
до средней трети плеча таким
образом, чтобы был
обеспечен свободный доступ к области
локтевого сгиба.
5. Наложить резиновый
жгут в области средней трети плеча выше
локтевого сгиба на 10 см и затянуть жгут,
чтобы петля жгута была направлена вниз,
а свободные его концы —
вверх (чтобы концы
жгута во время венепункции не попали
на обработанное спиртом поле).
6. Обработать одетые
в перчатки руки 70% раствором спирта.
7. Предложить
пациенту «поработать кулаком» — несколько
раз сжать и разжать кулак для
хорошего наполнения
вены.
8. Попросить пациента
сжать кулак и не разжимать до тех пор,
пока медсестра не разре-
шит; при этом дважды
обработать кожу в области локтевого
сгиба ватными шариками, смоченными 70%
раствором спирта, в одном направлении
— сверху вниз, сначала широко (размер
инъекционного поля составляет 4×8 см),
затем — непосредственно место пункции.
9. Найти наиболее
наполненную вену; затем кончиками
пальцев левой руки оттянуть кожу
локтевого сгиба
в сторону предплечья и фиксировать
вену.
10. В правую руку
взять приготовленный для пункции шприц
с иглой.
11. Провести
венепункцию: держа иглу срезом вверх
под углом 45°, ввести иглу под кожу;
затем, уменьшив
угол наклона и держа иглу почти параллельно
кожной поверхности, продвинуть иглу
немного вдоль вены и ввести её на треть
её длины в вену. При проколе вены возникает
ощущение «провала» иглы в пустоту.
12. Убедиться, что
игла находится в вене, слегка потянув
поршень иглы на себя; при этом
в шприце должна
появиться кровь.
13. Не снимая жгут,
продолжить тянуть поршень шприца на
себя для набора необходимого
количества крови.
14. Развязать жгут
и предложить больному разжать кулак.
15. Прижать ватный
шарик, смоченный в 70% растворе спирта,
к месту инъекции и быстро извлечь иглу.
В ряде случаев во
избежание повреждения форменных
элементов крови (например, при исследовании
агрегационной функции тромбоцитов)
кровь нельзя набирать шприцем. В такой
ситуации следует набирать кровь
«самотёком» — подставить под иглу (без
шприца) пробирку и подождать, пока она
заполнится необходимым количеством
крови.
16. Предложить
больному согнуть руку в локтевом сгибе
вместе с ватным шариком и оставить так
на 3-5 мин для остановки кровотечения.
17. Снять иглу со
шприца, медленно выпустить кровь в
пробирку по её стенке (быстрое поступление
крови в пробирку может привести к её
вспениванию и, следовательно, гемолизу
крови в пробирке) и закрыть пробирку
пробочкой.
18. Сложить
использованные материалы в специально
приготовленный лоток, снять перчатки.
19. Спросить у
пациента о его самочувствии, помочь ему
встать или удобно лечь.
20. Оформить
направление в лабораторию, поместить
штатив с пробирками в ёмкость для
транспортировки
биологических жидкостей (бикс) и отправить
в лабораторию для исследования.
NB!При
подозрении на гепатит или ВИЧ-инфекцию
у больного ёмкость с кровью необходимо
дополнительно парафинировать или
закрыть лейкопластырем и поместить в
герметичный контейнер.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
1. Оснащение:
стерильный скарификатор, укладка со стерильными капиллярами Панченкова (20 шт. в 1 упаковке), спирт 700 , планшет с пробирками, планшет для дозировки крови, капилляр Сали (0,02 мл.), резиновая груша, емкость с дезраствором, одноразовые (не стерильные) перчатки, халат, фартук, колпак, маска, пластиковые очки, вата, 2 предметных стерильных стекла (упаковка – 10 шт.), пробирки: № 1 на эритроциты – 4 мл – 3,5% раствор хлорида натрия, № 2 на гемоглобин – 5 мл трансформирующего раствора, № 3 на лейкоциты – 0,4 мл-3% раствора уксусной кислоты, 3 4 на СОЭ – 3,8% раствор стерильного оксилата натрия 0,025 мл.
2.Подготовка к процедуре:
1. забор крови у пациентов производится натощак;
2. приветствовать пациента, представиться;
3. объяснить пациенту цель и ход предстоящей процедуры и получить его согласие;
4. предложить пациенту удобно сесть;
5. вымыть и осушить руки, надеть перчатки;
6. обработать 4-ый (безымянный) палец пациента 700 спиртом;
7. левой рукой фиксировать палец пациента, а в правую руку взять скарификатор.
3.Выполнение манипуляции:
1. пунктировать на глубину 3-4 мм;
2. сухой стерильной ваткой снять первую каплю крови;
3. стерильным капилляром Панченко набираем 0,025 мл стерильного цитрата натрия, промывают его и сливают в пробирку с цитратом натрия;
4. этим же капилляром набирают полкапилляра крови и сливают в одну ячейку для дозирования, из которой набирают 0,02 мл крови капилляром Сали с грушей, снимают остатки крови с носика пипетки и выливают в пробирку № 1 (для эритроцитов);
5. из ячейки для дозирования берут 0,02 мл крови, выливают в пробирку № 2 (для гемоглобина);
6. 0,02 мл крови опускают в пробирку № 3 (для лейкоцитов);
7. 1 каплю крови капилляром Панченко опускают на предметное стекло и готовят тонкий мазок (под углом 450 специальным шлифовальным стеклом);
8. капилляр Панченко опускают в пробирку № 4 (на СОЭ);
9. обработать пациенту палец стерильной ватой, смоченной в спирте. Пациента отпускают.
4.Завершение процедуры:
1. мазок крови подписать, высушить на воздухе, поставить в штатив для фиксации. Упаковать в контейнер для транспортировки штатив с пробирками, с стеклами и штатив для дозировки крови.
2. В лаборатории:
а) подсчет эритроцитов в камере Горева;
б) измерение гемоглобина на ФЭКе;
в) подсчет лейкоцитов в камере Горева;
г) установка капилляра Паченкова в штатив Панченкова с кровью набранной до метки «0» на 1 час – определение СОЭ;
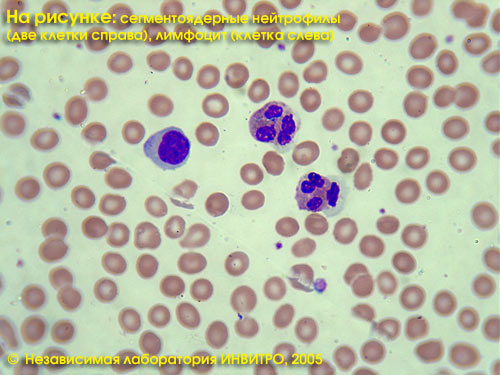
д) фиксация, окраска мазка крови и подсчет клеточных элементов (лейкоформулы) под микроскопом (иммерсия, увеличение 7*90)
3. Дезинфицирующий режим:
а) утилизация скарификатора на 1 час в 0,05% растворе анолита;
использованная вата и ветош – 1 час в 0,05 % растворе анолита;
остатки крови и реактивов с кровью – на 1 час в соотношении 5 6 1 с хлорной известью.
б) «0» – дезинфекция пробирок, капилляров, груш, штативов в 0,03% растворе анолита.
в) дезинфекция и предстерилизационная очистка совмещены – 90 минут в 0,03 % растворе анолита. Прополаскивание и стерилизация капилляров и стекол – в упаковке в биксе автоклавированием (1 час при 132 0 С, 1,2 атм.) Стекла кипятят в моющем растворе с перекисью водорода 1 час, сушат и стерилизуют автоклавированием.
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
Источник
Кровь для клинического анализа берут из IV пальца левой руки. Если это по каким-либо причинам сделать невозможно, то кровь можно получить из любого другого пальца. Наиболее удобным местом для укола является мякоть пальца слева от срединной линии, на некотором расстоянии от ногтя (у маленьких детей местом укола служит мочка уха, большой палец ноги или пятка).
· Подготовить на манипуляционном столе набор для забора крови из
пальца, проверив целостность упаковок и дату стерилизации:
· индивидуальное стерильное предметное часовое стекло или пробирку одноразового использования, стерильное предметное стекло для приготовления мазка крови, резиновый баллончик, перчатки.
· пригласить пациента;
· на рабочем столе оформить сопроводительные документы;
· помочь пациенту найти удобное положение;
· разъяснить пациенту суть предстоящей процедуры, создавая
атмосферу доверия, предоставляя возможность задать вопросы;
· вымыть руки;
· обработать руки спиртовым антисептиком;
· надеть чистые перчатки;
· Левой рукой лаборант захватывает IV палец левой руки обследуемого, слегка сдавливая при этом мякоть пальца в области предполагаемого укола. В правую руку лаборант берет иглу для одноразового пользования и располагает ее строго перпендикулярно относительно места предполагаемого укола. обработать подушечку пальца стерильным ватным шариком, смоченным спиртовым антисептиком;
· сбросить шарик в емкость для отходов «Класса. Б»;
· вскрыть одноразовый скарификатор и сделать прокол на подушечке
безымянного пальца. Укол лучше производить сбоку, где более густая
капиллярная сеть, на глубину 2-3 мм в зависимости от толщины кожи;
· использованный скарификатор сбросить в контейнер «Для колющих
и режущих инструментов»;
· сухим стерильным шариком убрать каплю крови с пальца
пациента, шарик сбросить в емкость для отходов «Класса Б»;
· произвести забор крови из пальца с использованием стерильных
капилляров или одноразовых пробирок;
Взятие крови для гематологических исследований может осуществляться 3 способами:
I. После прокола пальца несколько капель крови (не менее 3-4) спускают на индивидуальное предметное (часовое) стекло или гнездо пластикового планшета, перемешивают и используют для работы.
II. Кровь набирают индивидуальным, стерильным капилляром Панченкова, предварительно смоченным цитратом натрия.
III. После прокола кожи пальца, 6-8 капель крови спускают в пластиковую пробирку с антикоагулянтом. К» ЭДТА или К3ЭДТА (трилон Б) из расчета 1,5-2,2 мг на 1 мл крови, либо в специальные пластиковые пробирки одноразового пользования, обработанных. Сразу же после взятия пробу необходимо тщательно перемешать, перевернув пробирку крышкой вниз не менее 10 раз.
В случае использования 1 или 2 способа взятия крови в лаборатории заранее готовятся следующие пробирки с:
1. 4 мл 0,9% изотонического раствора натрия хлорида для подсчета числа эритроцитов,
2. 5 мл трансформирующего раствора для определения гемоглобина,
3. 0,4 мл 3% раствора уксусной кислоты для подсчета числа лейкоцитов.
4. 5% раствором трехзамещенного цитрата натрия, набранного в капилляр Панченкова до метки 25 и слитого в пробирку для определения СОЭ.
Сразу после взятия крови в 1, 2 и 3-ю пробирки добавляют по 20 мкл крови и несколько раз промывают пипетку в верхнем слое жидкости. Исследование крови начинают с разведения для эритроцитов, так как дальнейшая работа по определению количества лейкоцитов и содержания гемоглобина связана с использованием реактивов, лидирующих эритроциты. Для определения СОЭ в капилляр, промытый цитратом натрия, набирают кровь до метки 0 (100 делений) и выдувают ее в пробирку с раствором цитрата натрия (соотношение крови и реактива — 4:1), пробирку встряхивают.
Для исследования лейкоцитарной формулы, морфологии эритроцитов, лейкоцитов, тромбоцитов готовят мазки крови: вытирают место укола сухим шариком ваты и наносят каплю крови на сухое обезжиренное предметное стекло, затем быстро готовят тонкие мазки с помощью шлифованного стекла
Внимание! Кровь забирается только самотеком!
Источник