Спектральные анализ крови на гемоглобин

- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Щуплова Е.А.
1
Фадеев С.Б.
1
1 Институт клеточного и внутриклеточного симбиоза, Уральское отделение РАН (ИКВС УрО РАН)
Цель работы – спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности. Материал и методы. Для оценки влияния микроорганизмов на гемоглобин определяли оптические спектры проб (сканирующий спектрофотометр «Genesys 5», США), состоящих из 2 мл супернатанта суточной исследуемой культуры штамма и 0,5 мл взвеси отмытых донорских эритроцитов человека (в концентрации 106 кл/мл) через 2, 6 и 24 ч с момента приготовления указанной пробы. В работе использовались 30 штаммов стафилококков, обладающих антигемоглобиновой активностью. Результаты. Под влиянием супернатантов штаммов стафилококков происходило снижение оптической плотности проб, содержащих гемолизат эритроцитов, в диапазонах 220-450 нм. Наиболее выраженное снижение оптической плотности происходило под действием супернатантов штаммов с высокой антигемоглобиновой активностью (р
спектральный анализ
бактерии
гемоглобин
эритроциты
1. Артюхов В.Г., Вашанов Г.А., Козлова И.Е. УФ-чувствительность димеров гемоглобина в свободном состоянии и в составе гибридов валентности: модификация серотонином // Радиационная биология. Радиоэкология. — 2001. — Т. 41, № 2. — С. 190-194.
2. Бухарин О.В., Усвяцов Б.Я., Ханина Е.А. Взаимодействие бактерий и эритроцитов // Журн. микробиол. — 2005. — № 4. — С. 89-96.
3. Бухарин О.В., Усвяцов Б.Я., Ханина Е.А. Определение антигемоглобиновой активности микроорганизмов : патент России № 2262705.2005. Бюл. № 19.
4. Икрянникова С.В. Влияние экологических факторов на антиоксидантный статус и спектральные характеристики гемоглобина жителей промышленного города : дис. … канд. биол. наук. – Оренбург, 2006. — 119 с.
5. Ланг Т.А., Сесик М. Как описывать статистику в медицине. Аннотированное руководство для авторов, редакторов и рецензентов / пер. с англ. под ред. В.П. Леонова. — М. : Практическая медицина, 2011. — 480 с. : ил.
6. Путинцева О.В., Артюхов В.Г., Калаева Е.А. Оценка степени фотоповреждения хромофоров гемового и глобинового компонентов УФ-облученных молекул и электрофоретических фракций карбоксигемоглобина человека // Радиационная биология. Радиоэкология. — 2000. — Т. 40, № 4. — С. 439-445.
7. Справочник по микробиологическим и вирусологическим методам исследования / М.О. Биргер. — М. : Медицина, 1982. — 462 с.
8. Byrne D.P. Role of the cysteine protease interpain A of Prevotella intermedia in breakdown and release of hem from hemoglobin // J. Biochemistry. — 2010. — Vol. 425. — P. 257–264.
9. Perutz M.F., Heedner E.J., Zadner J.E. et al. Influence of globin structure on the state of the heme III changes in heme spectra accompanying allosteric transitions in methemoglobin and their implications for heme-heme interaction // J. Biochemistry. — 1974. — Vol. 13. — P. 2187-2200.
10. Pishchany G., Skaar E. P. Taste for Blood: Hemoglobin as a Nutrient Source for Pathogens // PLoS Pathogens. — 2012. – V. 8. — P. 1-4.
Введение
Гемоглобин эритроцитов представляет собой гетерогенную систему, включающую не только его производные (сульфгемоглобин, метгемоглобин, цианметгемоглобин), но и ряд продуктов необратимой окислительной деградации гемоглобина, причем соотношение между компонентами этой системы может меняться под воздействием различных экзогенных и эндогенных факторов. На молекулярном уровне эти изменения могут вызывать конформационные перестройки четвертичной структуры белковой части гемоглобина, влиять на состояние его простетической группы, изменять спиновое состояние гемового железа, степень его окисления (образования метгемоглобина), а также влиять на структурно-функциональные системы эритроцита [6]. Данные процессы взаимосвязаны и могут снижать сродство тетрамерной молекулы гемоглобина к кислороду, что в конечном итоге способствует развитию тканевой гипоксии и связанных с ней клеточных повреждений [4]. При развитии инфекционных процессов, сопровождающихся бактериемией, может наблюдаться феномен инвазии микроорганизмов внутрь эритроцитов [2]. При этом между эритроцитами, а точнее консолидированными компонентами крови и бактериями может происходить конкурентная борьба за гемовое железо, являющееся важным компонентом биохимических процессов, обеспечивающих рост, размножение бактериальных клеток и образование факторов патогенности [10]. Особенности влияния микроорганизмов на систему гемоглобина изучены недостаточно.
Цель настоящей работы – спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности.
Материал и методы
В работе использовали 30 клинических штаммов рода Staphylococcus (виды: S.epidermidis, S.saprophyticus, S.cohni и др.), выделенные из очагов гнойно-воспалительных заболеваний различной локализации [7], из них 15 штаммов с высоким уровнем (>3 г/л) антигемоглобиновой активности [3] и 15 – с низким (<3 г/л).
Для оценки влияния микроорганизмов на гемоглобин определяли оптические спектры пробы (сканирующий спектрофотометр «Genesys 5», США), состоящей из 2 мл супернатанта суточной исследуемой культуры штамма и 0,5 мл взвеси отмытых донорских эритроцитов человека (в концентрации 106 кл/мл) через 2, 6 и 24 ч с момента приготовления указанной пробы. В качестве контрольной использовали пробу, состоящую из 2 мл мясо-пептонного бульона (МПБ) и 0,5 мл взвеси эритроцитов в той же концентрации. Исследования проводили при постоянном температурном режиме 37 °С. Для проведения каждого измерения 0,5 мл исследуемой пробы смешивали с 0,5 мл дистиллированной воды с целью гемолиза эритроцитов. Оптическую плотность (ОП) определяли в диапазоне 450-700 нм. Полученные данные трактовали как изменение гемовой части гемоглобина [9]. Для оценки изменений в белковой части гемоглобина, вышеуказанную часть пробы дополнительно разводили дистиллированной водой в 2 раза и определяли оптическую плотность исследуемого раствора в диапазоне 220-450 нм [9].
Для оценки спектральных параметров метгемоглобина рассчитывали разностные спектры, которые строили относительно модельного спектра, содержащего оксигемоглобин [4]. Для нивелирования отличий спектральных характеристик, обусловленных разной концентрацией гемоглобина в пробах, вычисляли разностные спектры по нормированным спектрам относительно поглощения проходящего света с длиной волны 576 нм [6]. При оценке полученных графиков анализировали точки (диапазоны длин волн), соответствующие частотным интервалам поглощения проходящего света метгемоглобином и различными аминокислотами. Частотные интервалы метгемоглобина составляли для видимой области спектра: 502-505; 538-542; 560-565; 619-620; 629-632 нм и для ультрафиолетовой части спектра — 252; 268-272; 408-415 [4].
Полученные результаты были подвергнуты статистической обработке в компьютерной оболочке Windows с помощью процессора электронных таблиц Microsoft Office Excel 2007 c вычислением средней арифметической (M); средней ошибки (m); критерия значимости (t) Стьюдента. Различия считались значимыми (достоверными) при р<0,05 [5].
Результаты исследования
На первом этапе спектрального анализа гемоглобина под действием супернатантов исследуемых штаммов было установлено, что после 2 часов инкубации проб регистрировалось повышение значений оптической плотности в спектральном диапазоне (230-450 нм), соответствующем белковой части гемоглобина. При этом наибольшие значения ОП (0,130±0,001 ед.) регистрировались под действием штаммов с высоким уровнем АнтиНbА при длине волны 252 нм, что соответствует спектру поглощения ароматических аминокислот. При действии супернатантов штаммов с низким уровнем АнтиНbА, при равных условиях, значения ОП исследуемых проб (0,037±0,001 ед. ОП; р<0,05) было в 3,5 раза меньше. В контрольной пробе показания оптической плотности стремились к 0 (в сравнении с разностными спектрами), что свидетельствовало об отсутствии конформационных перестроек в белковой части гемоглобина.
При оценке спектра ОП контрольной и опытных проб через 6 ч инкубации с эритроцитами особое внимание обращали на диапазоны 246-270 нм, соответствующие полосам поглощения света аминокислотами белковой части гемоглобина и 398-422 нм – характерных для «порфиринового кармана». Показания оптической плотности проб в диапазоне, соответствующем аминокислотам (246-270 нм), под действием штаммов с высоким уровнем АнтиНbА снижались до отрицательных значений (рис. 1). Это может свидетельствовать о том, что гемовая часть в молекуле гемоглобина становится менее «защищенной» белковой структурой гемоглобина. Под действием штаммов с низким уровнем АнтиНbА наблюдали менее выраженное понижение значений оптической плотности проб в аналогичном интервале до -0,137±0,003 ед. ОП, однако в диапазоне 271-350 нм ОП увеличивалась до 0,225±0,002 ед. Такое изменение оптической плотности под действием штаммов с низким уровнем АнтиНbА свидетельствует о конформационных перестройках в белковой части гемового кармана. В контрольной пробе в диапазонах 254-366 нм (область, характерная для задержки проходящего света ароматическими и серосодержащими аминокислотами) значения ОП также оставались близкими к 0, т.е. структурные изменения белковой части гемоглобина не происходили. Под действием штаммов с высоким уровнем АнтиНbА в диапазоне 398-422 нм наблюдали снижение ОП до уровня -0,198±0,002 ед. При увеличении длины волны проходящего света регистрировалось повышение ОП этой же пробы до значения 0,063±0,006 ед. ОП (р<0,05). Такая существенная разница, по-видимому, свидетельствует о том, что наибольшие значения оптической плотности, соответствующие гемовой части гемоглобина, «смещаются» из коротковолновой в длинноволновую часть спектра. Данные изменения, вероятнее всего, связаны с тем, что микроорганизмы, изменяя белковую часть гемоглобина, затрагивают «порфириновый карман», где в гемовой части может происходить окисление железа, реализующееся в увеличении доли метгемоглобина в исследуемых пробах.
Под действием штаммов с низким уровнем АнтиНbА наблюдали аналогичные изменения ОП, которые характеризовались более низкими значениями: от -0,134±0,001 до 0,045±0,001 ед., свидетельствующие о меньшем воздействии на «порфириновый карман» и накоплении метгемоглобина.
При анализе спектральных характеристик опытных проб через 24 ч инкубации супернатантов исследуемых штаммов с эритроцитами наблюдали незначительное волнообразное изменение ОП, что говорило о дальнейших конформационных изменениях в белковой части гемоглобина. В контрольной пробе в диапазонах 230-290 нм наблюдали отрицательные значения оптической плотности.

Рисунок 1 — Изменения спектров белковой части гемоглобина в эритроцитах под действием супернатантов исследуемых штаммов (6 ч инкубации)
Второй этап исследований заключался в проведении спектрального анализа гемоглобина под действием супернатантов исследуемых культур в видимой области спектра (450-700 нм), позволяющего оценить долю образовавшегося метгемоглобина (МetHb). Через 2 ч инкубации происходило более выраженное увеличение оптической плотности опытных проб при длине волны проходящего света 560 нм (спектр поглощения, характерный для метгемоглобина) под действием штаммов с высоким уровнем АнтиНbА, чем с низким (0,024±0,001 против 0,019±0,001 ед. ОП; р<0,05; при пересчете на долю метгемоглобина — 6% против 4%). В контрольной пробе через 2 часа выявлялись отрицательные значения спектральных параметров полос поглощения света (при 502 нм — -0,025±0,001 ед. ОП; при 630 нм — -0,020±0,001 ед. ОП), что свидетельствует о снижении уровня метгемоглобина.
В ходе спектральной оценки образования метгемоглобина (при соответствующей длине волны проходящего света 502 нм) было установлено, что ОП проб после шестичасовой инкубации эритроцитов с супернатантами штаммов с высокой АнтиНbА характеризовались большими значениями, чем после воздействия на эритроциты штаммов с низким уровнем АнтиНbА (0,144±0,003 ед. ОП против — 0,063±0,002 ед. ОП, р<0,05; при пересчете на долю образующего метгемоглобина оказалось 9% против 4%). Спектральная оценка при длине волны 562 нм показала, что влияние штаммов с высоким уровнем АнтиНbА на образование метгемоглобина привело к большему снижению оптической плотности проб (0,032±0,001 ед. ОП; в пересчете на долю метгемоглобина — 8%), чем при воздействии изолятов с низким уровнем АнтиНbА (0,040±0,001 ед. ОП; при пересчете на долю метгемоглобина — 10%). Продолжение измерений при большей длине волны 632 нм выявило, что штаммы с высоким уровнем АнтиНbА, напротив, повышали оптическую плотность проб (0,070±0,004 ед. ОП; 9% МеtHb), по сравнению со штаммами, обладающими низким уровнем АнтиНbА (0,047±0,001 ед. ОП; р<0,05; 5% — МеtHb). В контрольной пробе значения спектральных параметров гемоглобина оказались отрицательными, что свидетельствует о наименьшем образовании метгемоглобина.
После 24 ч инкубации опытных проб наблюдали наиболее выраженные изменения значений спектров, соответствующих метгемоглобину, под действием штаммов с высоким уровнем АнтиНbА, чем с низким уровнем данного свойства (рис. 2). 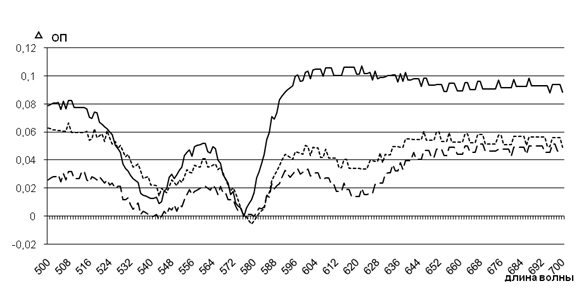
![]() — — — контроль штамм с высоким уровнем АнтиНbА ——— штамм с низким уровнем АнтиНbА
— — — контроль штамм с высоким уровнем АнтиНbА ——— штамм с низким уровнем АнтиНbА
Рисунок 2 — Изменения спектров гемовой части гемоглобина в эритроцитах под действием супернатантов исследуемых штаммов (24 ч инкубации)
При длине волны 619 нм наблюдали максимальные значения оптической плотности спектров проб под действием штаммов с высоким уровнем АнтиНbА, что в 3,1 раза выше, чем спектральные параметры проб под действием штаммов с низким уровнем данного свойства (0,106±0,001 против 0,034±0,001 ед. ОП; р<0,05), что указывает на значимое повышение долей метгемоглобина (в 3,3 раза, 13% против 4% соответственно). Спектральные характеристики контрольной пробы показали незначительное повышение оптической плотности полос поглощения света, что при пересчете на долю метгемоглобина составило 2-2,2%.
Обсуждение полученных результатов
Инфекционные процессы, сопровождающиеся транзиторной или постоянной бактериемией, как правило, клинически характеризуются развитием гипохромной анемии. Однако только в последние годы стало уделяться внимание взаимодействию гемоглобина и бактерий. Как известно, гемоглобин обладает антимикробным действием [2]. С другой стороны, микроорганизмы содержат широкий спектр средств защиты от факторов неспецифической противоинфекционной резистентности, в том числе и антигемоглобиновую активность [2]. Важным моментом во взаимодействии микроорганизмов с эритроцитами является возможность получения гемового железа при внутриклеточном персистировании.
В настоящей работе показано, что продукты жизнедеятельности стафилококков могут вызывать конформационные изменения белковой части гемоглобина, делая для бактерий доступным «порфириновый карман», содержащий собственно гем. Причем стафилококки с высоким уровнем АнтиНbА нарушают белковую структуру гемоглобина в большей степени, чем микроорганизмы с низкими показателями активности. Следующий момент воздействия бактерий на гемоглобин заключается в повышении доли его производного – метгемоглобина, содержащего не двух-, а трехвалентные ионы железа. Неспособность метгемоглобина рыхло и обратимо связывать кислород в конечном итоге может быть одним из факторов развития тканевой гипоксии. При этом штаммы с высоким уровнем АнтиНbА более «успешны», под их действием доля метгемоглобина увеличивается до 13%, тогда как под влиянием стафилококков с низкой АнтиНbА доля метгемоглобина через 6 часов инкубации достигает 10%, а к 24-м часам снижается до 4%. В последнем случае трансформация гемоглобина носит отчасти обратимый характер. В целом полученные результаты раскрывают первые этапы взаимодействия микроорганизмов с эритроцитами человека – нарушение конформационной структуры белковой части гемоглобина, «открытие» порфиринового кармана, переход оксигемоглобина в метгемоглобин. Все это дает возможность бактериям захватывать железо непосредственно из гема и использовать его для собственного бактериального метаболизма. Аналогичные результаты были получены зарубежными авторами при изучении влияния протеазы Prevotella intermedia на образование метгемоглобина [8]. В других работах были показаны изменения в молекуле гемоглобина под действием УФ-света, также приводящие к повышению образования метгемоглобина [1; 6].
Таким образом, спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности показал, что продукты жизнедеятельности бактерий способны нарушать конформационную структуру белковой части гемоглобина, а также влиять на гем, увеличивая долю метгемоглобина.
Авторы выражают благодарность к.б.н. Икрянниковой С.В. и д.м.н., профессору Красикову С.И. (кафедра медицинской и фармацевтической химии ОрГМА) за помощь в проведении исследований.
Рецензенты:
Карташова О.Л., д.б.н., профессор кафедры микробиологии и заразных болезней ФГБОУ ВПО «Оренбургский государственный аграрный университет», г. Оренбург.
Чайникова И.Н., д.м.н., профессор кафедры микробиологии, иммунологии и вирусологии ФГБОУ ВПО «Оренбургская медицинская академия», г. Оренбург.
Библиографическая ссылка
Щуплова Е.А., Фадеев С.Б. СПЕКТРАЛЬНЫЙ АНАЛИЗ ГЕМОГЛОБИНА ПОД ДЕЙСТВИЕМ МИКРООРГАНИЗМОВ С РАЗНЫМ УРОВНЕМ АНТИГЕМОГЛОБИНОВОЙ АКТИВНОСТИ // Современные проблемы науки и образования. – 2013. – № 2.;
URL: https://science-education.ru/ru/article/view?id=8791 (дата обращения: 22.03.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Исследование на гемоглобин — один из самых распространенных анализов крови, его может назначить врач любой специализации — от терапевта до иммунолога. Но почему же этот анализ считается таким универсальным? Какую информацию результаты могут сообщить доктору? Чем чреваты колебания уровня гемоглобина в крови у взрослых и детей? Обо всем этом — в нашей статье.
Что такое гемоглобин и какие анализы назначаются для определения его содержания
Гемоглобин — это соединение белка и железа, окрашивающее кровь теплокровных существ в красный цвет. Гемоглобин участвует в транспортировке кислорода и углекислого газа. От уровня этого белка в крови напрямую зависят все обменные процессы, происходящие в клетках. При его нехватке пациенту ставят диагноз анемия (малокровие). Уровень гемоглобина в крови можно поднять, если включить в рацион такие продукты, как говядина, печень, молочные продукты, яичный желток, бобовые, пророщенные злаки, красные ягоды, свекольный сок.
Кстати
Любимые многими сладости — темный шоколад и финики — способствуют повышению уровня гемоглобина.
Гемоглобин бывает физиологическим и патологическим. Физиологический гемоглобин может существовать в трех формах:
- HbО
2
— гемоглобин и кислород, образуется в основном в артериальной крови, делает ее ярко-красной;
- HbH — так называемый восстановленный гемоглобин, который уже «отдал» кислород клеткам;
- HbCO
2
— гемоглобин и углекислый газ, соединение присутствует в венозной крови, придает ей вишневый оттенок.
Но существуют и патологические формы гемоглобина:
- HbCO — соединение образуется в крови при вдыхании угарного газа, в таком состоянии гемоглобин не может соединяться с кислородом и транспортировать его;
- HbMet — образуется из-за воздействия на организм химикатов (нитриты, нитраты, лекарства);
- HbS — гемоглобин, деформирующий эритроциты; встречается у людей, больных дрепаноцитозом (серповидноклеточная анемия);
- HbА
1С
— гликозилированный, или гликированный, гемоглобин, его уровень нарастает при постоянной гипергликемии (повышенный уровень сахара в крови).
Последняя форма патологического гемоглобина встречается чаще других. Ее наличие в крови однозначно указывает на сахарный диабет, даже если он протекает в скрытой форме. Те, кому такой диагноз уже поставлен, должны постоянно сдавать кровь на уровень гликозилированного гемоглобина, чтобы определить эффективность лечения.
Уровень физиологического гемоглобина в крови покажет общий анализ крови, который мы сдаем в рамках диспансеризации (кровь из пальца). Чтобы определить концентрацию HbА1С, необходимо сдать кровь на биохимический анализ (обычно речь идет о сдаче венозной крови).
Какой анализ сдавать — общий или биохимический на гликозилированный гемоглобин — в конечном итоге решает врач.
Показания к назначению анализа крови на уровень гемоглобина
Общий анализ назначают в следующих случаях: общее обследование (диспансеризация), отслеживание результатов текущего лечения, диагностика болезней крови, назначение некоторых препаратов. Кроме того, общий анализ назначают для того, чтобы отследить обменные процессы в организме, выявить потребность в каких-либо химических элементах. Также пробы крови на анализ берут в течение всей беременности.
Главная причина назначения анализа крови на гликозилированный гемоглобин — сахарный диабет. Показания к назначению: симптоматика диабета (постоянная сухость во рту, участившиеся позывы к мочеиспусканию, быстрая утомляемость, нестабильный эмоциональный фон). Кроме того, этот анализ назначают для оценки риска осложнений сахарного диабета.
Подготовка к сдаче биоматериала на анализ каждого типа имеет некоторые особенности. От того, насколько тщательно пациент будет соблюдать предписания врача, зависит достоверность и точность результатов.
Как сдавать кровь на анализ уровня гемоглобина
Общий анализ крови не требует от пациента какой-либо особенной подготовки. Сдают кровь обязательно натощак — спустя 8–12 часов после приема пищи. В период вынужденного голодания разрешается пить только простую или минеральную воду. Самое удобное время для сдачи крови на общий анализ — утренние часы.
Анализ крови на гликозилированный гемоглобин не требует подготовки. Его не нужно сдавать натощак, пить перед ним можно что угодно, даже некрепкий алкоголь, не нужно воздерживаться от физических или эмоциональных нагрузок, не повлияет на результат и прием лекарств (кроме препаратов от диабета). Исследование отличается большей достоверностью, чем анализ крови на сахар или тест на толерантность к глюкозе с «нагрузкой». Однако данное исследование дороже, и сдать его можно не в каждом городе.
Технология сдачи общего анализа крови знакома, пожалуй, всем. Врач берет необходимое количество крови из пальца, и через пару дней вы получаете результат. При обращении в частную медицинскую организацию данные, возможно, будут готовы быстрее. В бланке анализа содержится информация о количестве эритроцитов (в том числе концентрация гемоглобина) и лейкоцитов, СОЭ и лейкоцитарная формула (не всегда).
Кровь на гликозилированный гемоглобин обычно берут из вены. Результат можно получить через три-четыре дня, он отразит концентрацию HbА
1С
, накопившегося за три месяца (срок жизни эритроцитов). С помощью этого исследования врач определяет тип диабета, а также контролирует течение болезни. Необходимо принять во внимание существование факторов, снижающих точность результата пробы, например, недавняя серьезная кровопотеря или гемолиз.
Получив бланк с результатами, пациент может самостоятельно их оценить, сравнив определенные в ходе анализа крови показатели с нормой. Однако вероятность того, поставленный непрофессионалом диагноз будет неточен, очень велика — все-таки подобные вопросы должен решать врач.
Расшифровка результатов анализа крови на уровень гемоглобина
Количество гемоглобина, в том числе и гликозилированного, может измеряться в разных единицах — г/л, мкмоль/л, Ед/л. Концентрация гликозилированного гемоглобина (HbА1С) обычно выражается в процентах к физиологическому гемоглобину (HbА).
Нормы содержания физиологического гемоглобина
Нормальной концентрацией гемоглобина в крови мужчин считается величина от 135 до 160 г/л. Кровь женщин меньше насыщена этим веществом — от 120 до 140 г/л. У новорожденных самый высокий уровень HbА — от 180 до 240 г/л, но с каждым днем он падает. Когда ребенку исполняется год, нормой считается концентрация 110–135 г/л, затем она начинает увеличиваться и к 15 годам достигает отметки в 115–150 г/л.
У мужчин старше 45 лет норма составляет 131–172 г/л, у женщин — 117-160 г/л. У мужчин старше 65 лет показатели нормы еще ниже — 112–174 г/л.
У многих с возрастом концентрация гемоглобина начинает падать. В связи с такой тенденцией пожилые люди имеют большую склонность к анемии (малокровию) и иногда нуждаются в специальной диете, повышающей уровень HbA.
Нормы содержания гликированного гемоглобина
В норме уровень гликозилированного (гликированного) гемоглобина у мужчин, женщин (в том числе беременных) и детей не должен быть больше 6,5%. Для людей в возрасте от 45 до 65 лет нормой является показатель, не превышающий 7%. Значение между 7 и 7,5% считается удовлетворительным, но все же пациенты с таким показателем входят в группу риска — в некоторых случаях ставится диагноз «преддиабетное состояние». Для пожилых старше 65 лет нормальный уровень гликированного гемоглобина составляет 7,5%, удовлетворительный — от 7,5 до 8%.
О чем говорят отклонения от референсных значений
Те или иные колебания показателей (в обе стороны) могут говорить о наличии патологий или предрасположенности к ним.
-
Повышенный гемоглобин в бланке анализа
Повышенный уровень гемоглобина может быть связан с сердечно-сосудистыми, кишечными или онкологическими заболеваниями. Превышение нормы часто фиксируется после переливания крови. Нехватка витамина В12 или фолиевой кислоты тоже вызывает повышение HbА.
Но повышенный гемоглобин не всегда говорит о патологии. Люди, живущие в высокогорных областях или работающие на большой высоте (пилоты) всегда имеют повышенный уровень физиологического гемоглобина.
Высокий уровень гликированного гемоглобина может означать развитие сахарного диабета, но точный диагноз врач может поставить только после проведения дополнительных исследований. -
Пониженный гемоглобин в бланке анализа
Низкая концентрация гемоглобина чаще всего вызвана неправильным питанием и образом жизни, явными или скрытыми кровопотерями (травмы, операции, болезни десен, донорство и др.). При инфекционных, аутоиммунных или каких-либо наследственных заболеваниях больной тоже может страдать пониженным HbА. В этих случаях показатель необходимо постоянно контролировать.
Пониженный уровень гемоглобина часто фиксируется во время беременности. Именно поэтому в период вынашивания женщинам следует особенно тщательно следить за своим рационом, включая в него большое количество железосодержащих продуктов.
Пониженный гликированный гемоглобин может быть обусловлен мощными выбросами инсулина. Такое бывает при опухоли поджелудочной железы. Долгие физические тренировки и низкоуглеводная диета тоже могут быть причинами пониженного HbА1С
.
Незначительные отклонения от нормы гемоглобина в крови можно скорректировать, изменив рацион и образ жизни. Однако если показатели сильно отличаются от нормальных, скорее всего, в организме протекают серьезные патологические процессы. От точности полученных результатов анализа на гемоглобин зависит правильность диагноза и эффективность последующего лечения, поэтому к выбору лаборатории нужно отнестись серьезно.
Источник

