Пробирка для общего анализа крови
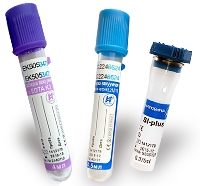

Вакуумная пробирка — основной инструмент для забора венозной крови. Она может быть наполнена реагентом, который позволит провести быстрый и точный анализ. В таком случае каждая пробирка имеет колпачок своего цвета. Цветное кодирование соответствует международному стандарту ISO 6710.
Вакуумные пробирки для получения сыворотки (биохимия, серология). Цвет крышечки – коричневый или красный
Сыворотка крови – жидкая часть крови лишенная форменных элементов и некоторых белков (фибрин и др.) в отличие от плазмы, в которой сохраняются все элементы жидкой части крови кроме форменных элементов.
Получение сыворотки крови является результатом двухступенчатого биохимического процесса: свертывания (коагуляции) крови и ретракции (уплотнения) сгустка. Для запуска коагуляционного каскада необходимо наличие внешнего активатора, каковым может служить кремния диоксид, поэтому процесс свертывания крови быстрее происходит в стеклянных пробирках, так как кремния диоксид является базовым материалом стекла или в пластиковых пробирках с активатором свертывания. Активатор свертывания (clot activator) выполнен в виде напыления на внутренней стенке пробирки.
После образования сгустка начинается этап его уплотнения и выделения сыворотки. На практике ретракция сгустка ускоряется центрифугированием пробирок с кровью.
Для получения максимально чистой сыворотки рекомендуется соблюдение трех условий:
1. После забора крови в пробирку в соответствии с инструкцией необходимо осторожно однократно перевернуть пробирку для более полного контакта крови с активатором свертывания;
2. Дождаться завершения процесса свертывания крови в течение 20-30 минут при комнатной температуре и вертикальном положении пробирки;
3. Центрифугировать пробирку со свернувшейся кровью не менее 10 минут с ускорением 1500 G (примерно 3000 об/мин) для максимального выдавливания сыворотки из сгустка. При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
После центрифугирования и полной ретракции сгустка сыворотка располагается над сгустком, но в контакте с ним. Сохраняется опасность загрязнения сыворотки составляющими сгустка при неосторожном обращении с пробиркой (встряхивание, опрокидывание и пр.). Для лучшего очищения сыворотки и более полного разграничения сыворотки и сгустка применяются специальные пробирки, содержащие биологически инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее сыворотки, но легче кровяного сгустка, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером. Стабильность такого барьера гарантирована в течение 5-7 дней при хранении пробирки с кровью при комнатной температуре.
Оптимальные сроки сохранности образца крови в данных пробирках составляет при комнатной температуре 6 часов, при хранении в холодильнике (+4ºС) – 24 часа. Повторное центрифугирование пробирок, особенно с гелем, не допускается.
Полученная сыворотка крови применяется для очень широкого спектра лабораторных биохимических, ИФА и иммунологических исследований:
белковый состав, ферменты, гормоны, онкомаркеры, ВИЧ-инфицирование, гепатиты и пр.
Вакуумные пробирки для получения цельной крови или плазмы
Не все анализы в клинике делаются из сыворотки крови. Для многих видов исследований необходима цельная кровь, содержащая форменные элементы, или плазма, освобожденная от клеток крови центрифугированием. С целью получения несвернувшейся крови разработаны пробирки с определенными добавками – антикоагулянтами. На практике используют два вида антикоагулянтов:
ингибиторы (вещества, вызывающие торможение) тромбина. Тромбин является ключевым игроком в коагуляционном каскаде. Он принимает участие в формировании ряда факторов свертывания крови и способствует трансформации фибриногена в фибрин. Добавление биохимических ингибиторов тромбина эффективно активирует антикоагуляционные свойства крови.
связывание (удаление) ионов Ca2+. При прочих равных условиях свертывание крови происходит при активном участии ионов Ca2+. Удаление их является эффективным механизмом сохранения крови в жидком состоянии.
Гепарин. Цвет крышечки – зеленый, светло-зеленый
Гепарин — кислый мукополисахарид с молекулярной массой 4000-40000 – является натуральным антикоагулянтом, присутствующем в любом здоровом организме. Гепарин активирует создание комплексных соединений между антитромбином III и такими факторами свертывания крови, как тромбин, факторы XIIa, XIa, Xa, IXa и VIIa. В таком комплексе факторы свертывания инактивируются необратимо.
Для целей получения плазмы крови в пробирки добавляют литиевую либо натриевую соль гепарина в пропорции к забираемой в пробирку кровью 15-20 МЕ/1 мл, что служит гарантией полной инактивации свертывания крови и не искажает исследуемые параметры. Эритроциты сохраняются в образце крови до 8 часов. Нельзя использовать для проведения анализов образец крови, хранившийся более 48 часов даже в условиях холодильника (+4ºС).
Для получения качественного результата анализа необходимо:
Немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и гепарина,
Плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин). При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
В клинике пробирки с гепарином применяются, в основном для проведения исследования:
электролитного состава крови,
газового состава крови,
содержания алкоголя в крови.
Не рекомендуется использовать гепарин для: морфологических исследований, так как кислотный характер гепарина способствует обесцвечиванию мазка крови, придавая ему голубоватый оттенок, подсчета лейкоцитов и тромбоцитов, поскольку гепарин стимулирует агрегацию этих клеток крови.
исследований по методике полимеразной цепной реакции (ПЦР).
Для более чистого разграничения плазмы крови и сгустка применяются специальные пробирки, содержащие кроме гепарина инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее плазмы, но легче форменных клеток крови, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером.
Фторид натрия/ЭДТА калия. Цвет крышечки – серый
Добавление фторида натрия и ЭДТА калия в пробирку позволяет предотвратить разрушение глюкозы крови (процесс, называемый гликолизом) и сохранить ее уровень во взятом образце крови.
Фторид натрия и оксалат калия выступают в качестве антикоагулянтов, связывая ионы Са2+ и, кроме того, фторид натрия стабилизирует уровень глюкозы.
Глюкоза разрушается до пирувата и лактата при последовательном осуществлении различных энзиматических реакций. Фторид натрия ингибирует некоторые ферментативные реакции, включая превращение фосфоглицерата в фосфоенолпируватацид, и предотвращает гликолиз.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин).
Пробирки с добавлением фторида натрия и оксалата калия используют для проведения определения уровня сахара (глюкозы) в крови. Соотношение компонентов 1/1, общее количество добавляемых реагентов – 4,5 мг/1 мл забираемой в пробирку крови.
Замечания: Фторид блокирует активность уреазы и некоторых других ферментов. Образцы крови из данных пробирок нельзя использовать для прямого определения энзимов. Фторид натрия и ЭДТА калия связывают ион Са2+, заменяя в крови 1 ион кальция на 2 иона натрия или калия. Следствием этого является повышение напряжения ионов в межклеточной жидкости и выкачивание воды из внутриклеточного пространства в межклеточное, сморщивание клеток крови с умеренным «выдавливанием» из эритроцитов гемоглобина. Поэтому видимый гемолиз свойственен образцам крови с данной добавкой.
Глюкоза превращается в лактат в результате комплекса реакций, включающего в себя различные этапы. Фторид ингибирует один их последних этапов разрушения глюкозы, начальные этапы с участием гексокиназы и фосфофруктокиназы блокируются менее эффективно, поэтому можно наблюдать снижение содержания глюкозы в образце крови на 6-7% от первоначального.
После первоначального незначительного снижения уровня глюкозы ее количество остается постоянным при хранении крови в пробирке в течение 8-10 часов при температуре до 25ºС и в течение 2-3 дней в холодильнике (+4ºС).
ЭДТА-К2. Цвет крышечки — сиреневый
Этилендиаминтетраацетат (ЭДТА) является предпочтительным антикоагулянтом для гематологических исследований. ЭДТА и его щелочные соли способны создавать хелатные соединения с ионами кальция с образованием растворимых высокостабильных комплексов. Наиболее эффективная концентрация ЭДТА – 1,2 мг/мл крови. Во всем мире используют три варианта солей ЭДТА: ЭДТА-К3, ЭДТА-К2 и ЭДТА-Na2. Наиболее предпочтительной и рекомендуемой Международной Комиссией по Стандартизации в Гематологии является двукалиевая соль ЭДТА:
ЭДТА-К3 показывает меньшую способность поддержания крови в жидком состоянии, также ЭДТА-К3 влияет на подсчет лейкоцитов, занижая их количество.
различия между ЭДТА-К2 и ЭДТА-Na2 в клиническом плане незначительны и ими можно пренебречь, но ЭДТА-Na2 хуже растворим.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта;
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин). При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
Наиболее широко используются пробирки, содержащие 1,95 мг ЭДТА/1мл крови. Они нашли свое применение в таких областях лабораторной практики, как:
гематологические исследования – подсчет клеток крови, определение СОЭ и пр.
ПЦР-исследования (качественные и количественные методики).
Пробирки с образцами крови можно хранить до 6-10 часов при 4ºС, хранение свыше 24 часов не рекомендуется из-за снижения числа эритроцитов и лейкоцитов.
Цитрат натрия. Цвет крышечки — голубой
Цитрат натрия является антикоагулянтом для сбора венозной крови с це6лью проведения исследований коагуляционных свойств крови.
Процесс свертывания крови представляет собой последовательность сложных реакций, в которых результатом первых реакций (с участием активных ферментов) является активация следующих, первоначально неактивных энзимов. Последним активным ферментом в этой цепочке присутствует тромбин, который осуществляет превращение фибриногена в фибрин. Нити фибрина опутывают клетки крови и окончательно формируют кровяной сгусток. Крайне важную роль на этом этапе играют ионы Са2+. Антикоагуляционные свойства цитрата проявляются в формировании комплекса с ионами Са2+ и эффективном удалении их из крови.
Общее исследование свертывания крови определяется временем, необходимым для последовательной активации ферментов, участвующих в коагуляционном процессе. Проводится определение времени активации и количественное измерение различных составляющих коагуляционного каскада, для чего создаются так называемые «обходные пути» добавлением некоторых промежуточных продуктов свертывания.
Наиболее часто используются пробирки с 3,8% или 3,2% раствором цитрата натрия (0,129 моль/л), соотношение цитрата к количеству забираемой крови 1/9.
Для максимально качественного проведения коагулологических исследований рекомендуется соблюдение определенных правил:
нельзя использовать пробирку для взятия крови на коагуляционные тесты первой, сразу после венепункции, так как на результаты может повлиять выделяющийся при пункции тканевой тромбопластин;
венозный жгут во время взятия крови в пробирку должен быть снят;
немедленно после взятия крови пробирку аккуратно переворачивают 5-6 раз для лучшего перемешивания крови и антикоагулянта;
сразу после этого надо проверить количество взятой крови: ее верхняя граница должна быть на уровне голубой полоски на этикетке.
Оптимальными условиями хранения пробирки с образцом крови является температура 20-24ºС и исследование коагуляционных свойств и факторов свертывания крови должно быть проведено в течение 2-х часов с момента взятия крови
Источник
Исследования крови
- Общий анализ крови (базовый, развернутый, развернутый с ретикулоцитарным и тромбоцитарным профилями)
Кровь сдается в утренние часы натощак (или в дневные/вечерние часы, спустя 4-5 часов после последнего приема пищи).
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Для общего анализа кровь забирается в вакуумную пробирку с фиолетовой крышкой (с ЭДТА). Для точного соотношения кровь-антикоагулянт необходимо набрать полностью всю пробирку до отметки или указанного объема крови! Осторожно перемешать 5-6 раз.
- Биохимический анализ крови (базовый, развернутый, профильные и отдельные показатели биохимии)
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов (желательно, не менее 12 часов). При исследовании глюкозы за день исключить из рациона сладкое. За 1 день до исследования не злоупотреблять жирной пищей
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Для биохимических исследований кровь берется в вакуумную пробирку с красной крышкой без наполнителя. Не перемешивать!
- Исследования на гормоны
Исследования на гормоны в основном проводится натощак. С последнего приема пищи должно пройти не менее 8 часов (желательно, не менее 12 часов).
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Для исследований на гормоны кровь берется в вакуумную пробирку с желтой крышкой без наполнителя. Не перемешивать!
- Аллергологические исследования
Аллергологические исследования проводятся натощак. С последнего приема пищи должно пройти не менее 8 часов (желательно, не менее 12 часов).
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Для исследований на аллергены кровь берется в вакуумную пробирку с желтой крышкой без наполнителя. Не перемешивать!
- Иммунологические исследования
А) Иммунограмма, чувствительность к иммуномодуляторам
Кровь сдается в утренние часы натощак (или в дневные/вечерние часы, спустя 4-5 часов после последнего приема пищи).
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь берется в 3 пробирки – в пробирку с зеленой крышкой (гепарин), осторожно перемешать 5-6 раз; в пробирку с сиреневой крышкой (ЭДТА), осторожно перемешать 5-6 раз; в пробирку с красной крышкой без наполнителя, не перемешивать!
Б) Интерфероновый статус, суммарные иммуноглобулины А,М,G, компоненты комплемента С3, С4
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов.
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с красной крышкой без наполнителя, не перемешивать!
- Исследования инфекционных заболеваний методом ИФА
Кровь берется в утреннее, дневное время спустя 4 – 5 ч. после последнего приема пищи.
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с сиреневой крышкой. Осторожно перемешать 5-6 раз.
- Лекарственный мониторинг
А) Такролимус, сиролимус, циклоспорин
Время взятия пробы крови должно соответствовать рекомендованному врачом промежутку времени после приёма препарата. Если нет других указаний врача, исследование проводят на спаде концентрации через 12 часов после приёма препарата (перед очередным приёмом).
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с сиреневой крышкой. Осторожно перемешать 5-6 раз.
Б) Дигоксин, карбамазепин, фенобарбитал, гентамицин, ванкомицин, салицилаты
Время взятия пробы крови должно соответствовать рекомендованному врачом промежутку времени после приёма препарата. Если нет других указаний врача, исследование проводят на спаде концентрации через 12 часов после приёма препарата (перед очередным приёмом).
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с красной крышкой без наполнителя, не перемешивать!
- Маркеры фиброза печени
Прямой фибротест
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. Накануне исследования не следует злоупотреблять жирной пищей.
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с красной крышкой без наполнителя, не перемешивать!
- Маркеры сепсиса
Прокальцитонин
Поскольку анализ на прокальцитонин проводится у пациентов в критическом состоянии, специальной подготовки к исследованию не требуется. При возможности взятие крови проводится натощак, в утренние часы.
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с сиреневой крышкой (ЭДТА), осторожно перемешать 5-6 раз!
Б) ЛБП (Липополисахаридсвязывающий протеин)
Поскольку анализ на ЛБП проводится у пациентов в критическом состоянии, специальной подготовки к исследованию не требуется. При возможности взятие крови проводится натощак, в утренние часы.
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с красной крышкой без наполнителя или пробирку с желтой крышкой с разделительным гелем, не перемешивать!
- Аутоиммунные маркеры
А) Антитела к одно- и двуцепочечной ДНК, Антитела к тканевой трансглутаминазе, Анитела к бета-2-гликопротеину
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с сиреневой крышкой (ЭДТА), осторожно перемешать 5-6 раз!
Б)Антинуклеарные антитела(АNA), Антимитохондриальные антитела (АМА), Антиспермальные антитела (АСА), Анти-ЦЦП, Антитела к микросомам печени и почек типа 1(LKM1) и цитозольный антиген печени типа 1( LC1)
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с красной крышкой без наполнителя или пробирку с желтой крышкой с разделительным гелем, не перемешивать!
- Онкомаркеры
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с красной крышкой без наполнителя, не перемешивать!
- Исследования гемостаза
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с голубой крышкой (цитрат натрия), осторожно перемешать 3-4 раза!
Исследования мочи
- Общий анализ мочи и анализ мочи по Нечипоренко
Накануне сдачи анализа рекомендуется пить обычное количество жидкости, не употреблять овощи и фрукты, способные изменить цвет мочи (свекла, морковь и пр.), не принимать диуретики. Перед сбором мочи необходимо провести тщательный туалет половых органов. Женщинам не рекомендуется сдавать во время менструации. Сбор мочи необходимо проводить обязательно до эндоуретральных процедур. Несоблюдение данных правил может привести к изменению результатов анализа.
Взятие материала. После гигиены наружных половых органов для анализа отбирают порцию утренней мочи в количестве 50 -100 мл в специальный контейнер для мочи с четко написанным направлением. Мочу необходимо доставить в лабораторию в течение 1-3 часов. Длительное хранение мочи до исследования приводит к изменению её физико-химических свойств.
Исследования спермы
Спермограмма
Требуется полное половое воздержание в течение 3-5 дней перед исследованием, но не более 7 дней. В направлении необходимо указать принимаемые в данный момент медикаментозные препараты (лекарства). Нельзя собирать материал из презерватива!
Взятие материала. Сбор материала лучше проводить в утренние часы. Необходимо отметить на направлении время сбора материала, с этого времени и до момента доставки в лабораторию должно пройти не более 30-40 минут. Материал доставляется в стерильных контейнерах, при температуре тела (под мышкой, во внутреннем кармане пиджака, брюк).
Микроскопические исследования
Микроскопия урогенитальных мазков на микрофлору у мужчин
В течение 3 часов до исследования воздержаться от мочеиспусканий, не проводить туалет наружных половых органов. Для микроскопии урогенитальных мазков на микрофлору используется предметное стекло.
Взятие материала. биоматериалом служит урогенитальный мазок, который берется следующим образом:
- Попросить пациента оголить головку полового члена путем сдвигания крайней плоти.
- Обработать головку полового члена в области наружного отверстия уретры тампоном, смоченным стерильным физиологическим раствором.
- При наличии свободно стекающих из уретры выделений удалить их сухим тампоном.
- Ввести зонд в уретру на глубину 3–4 см.
- Несколькими осторожными вращательными движениями в течении 3–5 секунд произвести забор биоматериала.
- Вынуть зонд из уретры.
- Биоматериал, взятый с помощью зонда, нанести на предметное стекло равномерно.
- Высушить предметное стекло на воздухе при комнатной температуре в течение 30 минут.
- Стекло поместить в пластиковый контейнер и доставить в лабораторию.
Микроскопия урогенитальных мазков на микрофлору у женщин
Накануне обследования не следует проводить спринцевание, туалет наружных половых органов с применением средств интимной гигиены. Исследование следует проводить перед менструацией или через 1–2 дня после ее окончания. Для микроскопии урогенитальных мазков на микрофлору используется предметное стекло.
Взятие материала. биоматериалом служит урогенитальный мазок с трех участков, который собирается следующим образом:
- Забор биоматериала производится с трех участков: наружное отверстие цервикального канала (C), задний свод влагалища (V), наружное отверстие мочеиспускательного канала (U). Подписать предметное стекло в направлении слева направо водостойким маркером.
- Ввести гинекологическое зеркало (зеркало Куско).
- Установить зеркало в положение, при котором наиболее четко возможно осмотреть шейку матки, задний свод влагалища (обнажить шейку в зеркалах).
- Избыток слизи и обильных выделений удалить с помощью пинцета стерильным тампоном.
- Ввести урогенитальный зонд в цервикальный канал на глубину 1–2 см, собрать материал осторожными вращательными движениями в течение 3–5 секунд.
- Нанести мазок в центре предметного стекла равномерно.
- Провести урогенитальным зондом по поверхности слизистой влагалища в области заднего свода
- Нанести мазок в центре предметного стекла равномерно.
- Извлечь гинекологическое зеркало.
- Ввести урогенитальный зонд в уретру на глубину 1–1.5 см, аккуратно, не поранив слизистую, несколькими вращательными движениями произвести соскоб эпителиальных клеток.
- Нанести мазок на предметное стекло справа равномерно.
- Высушить предметное стекло на воздухе при комнатной температуре в течение 30 минут.
- Стекло поместить в пластиковый контейнер и доставить в лабораторию.
ПЦР-исследования
ПЦР-исследования крови
Кровь берется в утреннее, дневное время спустя 4 – 5 ч. после последнего приема пищи.
Взятие материала. Материалом для исследования является венозная кровь, которая берется из локтевой вены. Кровь на эти исследования берется в пробирку с сиреневой крышкой (ЭДТА). Осторожно перемешать 5-6 раз.
ПЦР-исследования слюны
Непосредственно перед сбором слюны необходимо исключить использование зубной пасты и удалить зубные протезы.
Взятие материала. Слюну выплевывают в стерильный контейнер с 1 мл. физ.раствора и доставляют в лабораторию.
ПЦР-исследования мочи
Специальной подготовки для ПЦР-исследований в моче не требуется.
Взятие материала. Биоматериалом служит разовая порция мочи, котрая собирается в стерильный контейнер. Минимальный объем мочи, необходимый для проведения анализа, составляет 20 мл. Мочу необходимо доставить в лабораторию как можно быстрее, так как длительное хранение мочи при комнатной температуре до исследования приводит к изменению не только ее физических свойств и к разрушению клеток, но и к размножению бактерий.
ПЦР-исследования в урогенитальном мазке у мужчин
В течение 3 часов до исследования воздержаться от мочеиспусканий, не проводить туалет наружных половых органов. Для ПЦР — исследований используется пробирка с транспортной средой (физ.раствор, 2-3мл)
Взятие материала. Взятие материала: биоматериалом служит урогенитальный мазок, который берется следующим образом:
- Попросить пациента оголить головку полового члена путем сдвигания крайней плоти.
- Обработать головку полового члена в области наружного отверстия уретры тампоном, смоченным стерильным физиологическим раствором.
- При наличии свободно стекающих из уретры выделений удалить их сухим тампоном.
- Ввести зонд в уретру на глубину 3–4 см.
- Несколькими осторожными вращательными движениями в течении 3–5 секунд произвести забор биоматериала.
- Вынуть зонд из уретры.
- Перенести зонд в пробирку со средой.
- Погрузив рабочую часть зонда, вращать зонд в течение 10 секунд, избегая разбрызгивания раствора.
- Вынуть зонд из раствора, отжать избыток жидкости, прижимая к стенке пробирки, удалить зонд.
- Закрыть пробирку и доставить в лабораторию.
ПЦР-исследования в урогенитальном мазке у женщин
Накануне обследования не следует проводить спринцевание, туалет наружных половых органов с применением средств интимной гигиены. Исследование следует проводить перед менструацией или через 1–2 дня после ее окончания. Для ПЦР — исследований используется пробирка с транспортной средой (физ.раствор, 2-3мл)
Взятие материала. биоматериалом служит урогенитальный мазок с трех участков, который собирается следующим образом:
- Ввести гинекологическое зеркало (зеркало Куско).
- Установить зеркало в положение, при котором наиболее четко возможно осмотреть шейку матки, задний свод влагалища (обнажить шейку в зеркалах).
- Избыток слизи и обильных выделений удалить с помощью пинцета стерильным тампоном.
- Ввести урогенитальный зонд в цервикальный канал на глубину 1–2 см, собрать материал осторожными вращательными движениями в течение 3–5 секунд.
- Вынуть зонд и перенести его в пробирку со средой.
- Погрузив рабочую часть зонда, вращать зонд в течение 10 секунд, избегая разбрызгивания раствора.
- Вынуть зонд из раствора, отжать избыток жидкости, прижимая к стенке пробирки, удалить зонд.
- Провести урогенитальным зондом по поверхности слизистой влагалища в области заднего свода.
- Перенести зонд в ту же пробирку со средой.
- Погрузив рабочую часть зонда, вращать зонд в течение 10 секунд, избегая разбрызгивания раствора.
- Вынуть зонд из раствора, отжать избыток жидкости, прижимая к стенке пробирки, удалить зонд.
- Извлечь гинекологическое зеркало.
- Ввести урогенитальный зонд в уретру на глубину 1–1.5 см, аккуратно, не поранив слизистую, несколькими вращательными движениями произвести соскоб эпителиальных клеток.
- Перенести зонд в ту же пробирку со средой.
- Погрузив рабочую часть зонда, вращать зонд в течение 10 секунд, избегая разбрызгивания раствора.
- Вынуть зонд из раствора, отжать избыток жидкости, прижимая к стенке пробирки, удалить зонд.
- Закрыть пробирку и доставить в лабораторию.
Источник


