Pai анализ крови что это
SERPINE1 (PAI-1)
Ингибитор активатора плазминогена 1 является одним из основных компонентов антисвертывающей системы крови. Ингибитор активатора плазминогена образуется в эндотелиальных клетках, гепатоцитах, депонируется в тромбоцитах в неактивной форме. Время полужизни активной молекулы в кровотоке – около 2 часов . Основная функция ингибитора активатора плазминогена 1 – ограничить фибринолитическую активность местом расположения гемостатической пробки за счет ингибирования тканевого активатора плазминогена. Это выполняется за счет большего содержания его в сосудистой стенке по сравнению с тканевым активатором плазминогена. Таким образом, на месте повреждения активированные тромбоциты выделяют избыточное количество ингибитора активатора плазминогена 1, предотвращая преждевременный лизис фибрина.
Редко встречающийся дефицит PAI-1 вызывает усиление фибринолиза и сопровождается кровотечениями.
Концентрация PAI-1 зависит как от внешних (уровень триглицеридов , курение ), так и внутренних (генетических) факторов.
PAI является белком острой фазы . Его активность возрастает после больших
операций, тяжелых травм, инфаркта миокарда. После введения в организм
кортикостероидов, эндотоксина (бактериальный LPS) активность PAI нарастает.
Статины вызывают снижение экспрессии гена PAI-1 . Уровень тканевого
активатора плазминогена в плазме пострадавших с травматическим шоком
уменьшается в 2—3 раза, а его ингибитора в 1,8—2 раза .
Выявлено повышенное содержание PAI-1 в тучных клетках, что подтверждает
участие этого белка в патогенезе бронхиальной астмы и других IgE-
опосредованных аллергических заболеваниях . Также показано участие PAI-1 в
ремоделировании дыхательных путей.
Активность PAI в течение беременности постепенно нарастает, и в третьем
триместре концентрация PAI-2 повышается до 100 мкг/мл (определяется
иммунологическим методом), особенно при действии отягощающих беременность
факторов, а после родов возвращается к норме.
У больных инфарктом миокарда отмечено повышение активности PAI и снижение
содержания и активности тканевого активатора. Часто активность PAI повышается
у больных венозными тромбозами. Повышение PAI у таких больных в
предоперационном периоде угрожает послеоперационным тромбозом.
PAI-1 участвует в ремоделировании сосудов и репарации тканей . Показано, что
высокий уровень PAI-1 тормозит образование intima media артерий .
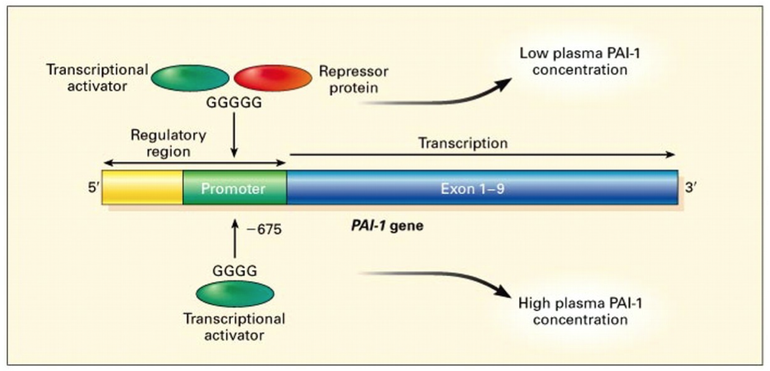
Полиморфизм -675 5G>4G.
Полиморфный вариант 4G затрагивает промоторную область и сопровождается
повышенной экспрессией гена и повышением уровня PAI-1 в крови . В результате
снижается активность тромболитической системы.
Различия в фенотипических проявлениях генотипа PAI-1 обусловлены тем, что с
промотором гена 5G может связываться как активатор, так и репрессор, а с
промотором гена 4G — только активатор. Поэтому ген 5G, легко включается и легко
выключается, а ген 4G легко включается, но плохо выключается (Рисунок 2).
Рисунок 2. Регуляция экспрессии гена PAI-1
По-видимому, на фенотипическое проявление данного полиморфизма
существенное влияние оказывает генетический фон, т.к. имеются существенные
различия в зависимости от расы и пола . У китайцев 4G аллель сильнее влияет на
уровень PAI-1 у женщин, чем у мужчин.
Популяция | Частота встречаемости генотипа, % | ||
5G/5G | 5G/4G | 4G/4G | |
Европейская | 35 | 39 | 26 |
Африканская | 58 | 33 | 9 |
Клинические проявления
• Снижение фибринолитической активности крови
• Риск тромбообразования возрастает примерно в 1,7 раза как у гомозигот, так и у гетерозигот.
Дополнительные факторы риска:
• Дефицит протеина S. Показано, что риск венозных тромбозов
увеличивается только у пациентов, имеющих дефицит протеина S и
гомозиготных по 4G аллелю.
• Избыточная масса тела
• Гипертриглицеридемия
• Сердечно-сосудистые заболевания
Для гетерозиготного состояния данного полиморфизма (4G/5G) риск
сердечно-сосудистых заболеваний возрастает незначительно .
Дополнительные факторы риска:
Ожирение
Гипертриглицеридемия
Максимальный риск сердечно-сосудистой патологии у гомозигот
наблюдается при гипертриглицеридемии .Резистентность к инсулину
Восстановление после эпизодов сердечно-сосудистых заболеваний
Носители аллеля 4G имеют повышенный риск ишемии и неблагоприятного
исхода вне зависимости от этиологии первичного эпизода (ишемический
или геморрагический) .Преэклампсия 5G/4G OR=1.49
Бронхиальная астма . Для носителей 4G аллеля характерно снижение
объема форсированного выдоха и повышение чувствительности бронхов к
гистамину у пациентов с аллергией на домашнюю пыль.
У гетерозигот 5G/4G повышен риск развития бронхиальной астмы при
аллергии на домашнюю пыль (OR=2.81) .Дополнительные факторы риска:
Генотип CD14: -159 C/C
• Данные о связи 4G аллеля с повышением риска венозной тромбоэмболии
при ГЗТ и ОК практически отсутствуют. По-видимому, большее влияние на
возникновение тромбоза в этой ситуации имеет снижение естественных
антикоагулянтов и курение .
Рекомендованные дополнительные исследования
Активность ингибитора активатора плазминогена.
Активность плазминогена.
Уровень триглицеридов
Индекс атерогенности
Уровень протеина S
Источник
Проблема синдрома привычной потери плода при- стально изучается исследователями и не теряет акту- альности в течение нескольких десятилетий. Особое внимание уделяется клеточно-молекулярным взаимо- действиям в тканях эндометрия и плаценты. Течение беременности и ее исход зависят от условий, в которых происходили имплантация и дальнейшее формирова- ние плаценты. Иммуно-эндокринные взаимодействия и ангиогенез непосредственно влияют на локальный эндометриальный гемостаз. В результате в физиологи- ческих условиях внутрисосудистый кровоток сохраня- ется за счет повышенной коагуляционной активности в периваскулярных областях и высокой фибринолити- ческой активности в просвете эндометриальных сосу- дах. В создании такого равновесия принимает участие весь комплекс плазменных факторов: активаторов и ингибиторов коагуляции и фибринолиза. В настоя- щее время известна роль генетически обусловленных дефектов гемостаза, приводящих к тромбозам, тром- боэмболиям, а также акушерским осложнениям, таким, как привычное невынашивание, неудачные попытки ЭКО, гестоз, преждевременная отслойка нормально расположенной плаценты и т.д. Целью нашего исследования явилась попытка определить роль полиморфизма гена PAI-1 в аку- шерской патологии у женщин с привычной поте- рей плода. Было обследовано 90 женщин в возрас- те от 20 до 39 лет с привычным невынашиванием. В ходе обследования сформировано 3 группы: 1 ос- новную группу составили 30 женщин с гомозигот- ным генотипом 4G/4G (PAI-1), во 2 основную груп- пу вошли 30 женщин с гетерозиготным генотипом гена PAI-1, 3 — группа сравнения была представле- на 30 пациентками, не имевшими полиморфизма в гене PAI-1. Определение аллельного полиморфизма 4G/5G в гене PAI-1 проводили методом полимераз- ной цепной реакции (ПЦР). Изучение тромбоцитар- ного звена свертывающей системы крови состояло из определения числа тромбоцитов в венозной крови, морфологической оценки внутрисосудистой актива- ции тромбоцитов по методу А.С. Шитиковой (1992). Комплексное исследование плазменно-коагуляцион- ного звена гемостаза включало такие методы, как: время свертывания венозной крови, активирован- ное время рекальцификации плазмы, протромбино- вый индекс, концентрация фибриногена, активность фактора VIII. Для оценки фибринолитической актив- ностикрови использовали метод определения лизиса эуглобулиновой фракции плазмы и фибринолитиче- скую активность цельной крови. Определение уров- ня гомоцистеина в плазме крови проводили методом иммуноферментного анализа. При анализе анамнестических данных было вы- явлено, что у 28 (31,1 %) женщин репродуктивным неудачам предшествовало прерывание первой бере- менности путем медицинского аборта, у 56,0 (62,2 %) пациенток произошли самопроизвольные выкидыши, начиная с первой беременности, у 63,0 (70,0 %) об- следованных была выявлена неразвивающаяся бере- менность. Среди инфекций половых путей чаще всего встречалась кандидозная (23,3 %), уреаплазменная (18,8 %), микоплазменная (6,6 %). Отмечались еди- ничные случаи генитального герпеса и хламидиоза. У 46,6 % женщин был выявлен хронический эндо- метрит, в 35,5 % визуализировалась эктопия шейки 8 матки, у 16,6 % пациенток обнаружены признаки хронического сальпингооофорита и миомы матки. Исследование параметров гемостаза проводилось в условиях отсутствия обострения бактериально-ви- русной инфекции в период с 15 дня менструального цикла до наступления менструации. До беременности в показателях гемостаза достоверных различий между группами не обнаружено. При беременности в I три- местре в группе женщин с гомозиготным состоянием гена PAI-1 были выявлены признаки гиперкоагуля- ции, в группе с гетерозиготным состоянием гена PAI-1 и группе сравнения отмечались нормальные параме- тры гемостаза. Во II и III триместрах гиперкоагуляция сохранялась в 16,6 % наблюдений у пациенток 1 основ- ной группы и в 10,0 % у пациенток 2 основной группы (p<0,05). Было проанализировано течение настоящей беременности у обследованных женщин. Следует от- метить, что отслойки хориона до 8 недель беременно- сти с последующим образованием ретрохориальной гематомы встречались в группе женщин с гомозигот- ным состоянием гена PAI-1 в 23,3 % случаев и сопро- вождались низкой плацентацией в I–II триместрах в 20,0 % наблюдений. В III триместре у 3 (10,0 %) па- циенток данной группы выявлено предлежание пла- центы. Признаки фето-плацентарной недостаточно- сти обнаружены в 16,6 % случаев (p<0,05) у женщин из 1 и 2 основных групп. Отеки беременных достовер- но чаще (p=0,05) встречались у женщин с наличием полиморфизма гена PAI-1, чем в группе сравнения. В настоящее время варианты полиморфизмов гена PAI-1 связывают с повышением концентрации PAI-1 в плазме. Наиболее частый полиморфизм 4G/5G ас- социируют с повышенной PAI-1 активностью, при гомозиготном носительстве 4G аллеля активность PAI-1 еще выше, что приводит к нарушению контро- ля за фибринолитической активностью, гиперкоагу- ляции и последующему тромбозу. Более углубленное изучение системы фибринолиза представляет собой научно-практический интерес и раскрывает возмож- ности для дальнейшего установления причин син- дрома привычной потери плода.
МАТЬ И ДИТЯ, Москва
XII Всероссийский научный форум, 2011
Источник
Информация об исследовании
Название гена: PAI1 (SERPINE1) (Ингибитор активатора плазминогена, тип 1) / serpin peptidase inhibitor, clade E (nexin, plasminogen activator inhibitor type 1), member 1)
Исследуемый полиморфизм: 4G/5G (PAI1: 4G/5G; Ins/Del G)
Функция гена: кодирует ингибитор активатора плазминогена 1, который является одним из компонентов свертывающей системы крови (фибринолитическое звено гемостаза). Белок PAI-1 ингибирует активность тканевого активатора плазминогена (PLAT), отвечающего за образование плазмина, и т.о. подавляет фибринолиз кровяных сгустков.
Ингибитор-1 активатора плазминогена также является маркером воспаления. PAI -1 играет важную роль в процессе фибринолитического контроля при беременности как фактор маточно–плацентарной циркуляции. Дисбаланс маточно–плацентарного фибринолитического контроля в результате повышенной продукции PAI–1 связан не только с повышением уровня фибрина в маточных сосудах и снижением маточно–плацентарного кровотока, но также играет важную роль в снижении степени инвазии трофобласта на ранних сроках беременности. Таким образом, повышенная продукция PAI–1 создает предпосылки для развития в дальнейшем гестоза и задержки внутриутробного роста плода.
Характерные проявления мутации:
- различная патология беременности (ранние и поздние выкидыши, развитие ранних и поздних гестозов, преждевременная отслойка нормально расположенной плаценты, фето-плацентарная недостаточность, преэклампсия, эклампсия, HELLP-синдром)
- тромбоэмболические осложнения, артериальные и венозные тромбозы, инфаркт миокарда, инсульт
- онкологические заболевания (риск развития рака предстательной железы)
Полиморфизм 4G/5G в гене PAI-1 связан с повышением уровня PAI-1 и тромбоэмболизмом.
Показания к назначению исследования:
- Тромбозы в анамнезе у пациента или у близких родственников;
- Подготовка к операции;
- Подготовка к беременности;
- Подготовка к приему оральных контрацептивов;
- Подготовка к гормонозаместительной терапии.
- Выявления генетической предрасположенности к инфаркту миокарда ишемической болезни сердца;
- При патологии беременности (преэклампсия, ранние и поздние выкидыши, гестозы, преждевременная отслойка нормально расположенной плаценты, фето-плацентарная недостаточность, HELLP-синдром);
- Атеросклероз;
- Увеличение массы тела и ожирение;
- Имеет прогностическую значимость при менингококковой инфекции.
Мутация встречается у мужчин и женщин с одинаковой частотой, для развития заболевания достаточно унаследовать 1 мутантный вариант гена от одного из родителей, вероятность возникновения болезни у детей составляет 50 %.
Специальной подготовки к исследованию не требуется. Необходимо следовать общим правилам подготовки к исследованиям.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К ИССЛЕДОВАНИЯМ:
1. Кровь рекомендуется сдавать утром, в период с 8 до 11 часов, натощак (между последним приемом пищи и взятием крови должно пройти не менее 8-ми часов, воду можно пить в обычном режиме), накануне исследования легкий ужин с ограничением приема жирной пищи.
2. Накануне исследования (в течение 24 часов) исключить алкоголь, интенсивные физические нагрузки, прием лекарственных препаратов (по согласованию с врачом).
3. За 1-2 часа до сдачи крови воздержаться от курения, не употреблять сок, чай, кофе, можно пить негазированную воду. Исключить физическое напряжение (бег, быстрый подъем по лестнице), эмоциональное возбуждение. За 15 минут до сдачи крови рекомендуется отдохнуть, успокоиться.
4. Не следует сдавать кровь для лабораторного исследования сразу после физиотерапевтических процедур, инструментального обследования, рентгенологического и ультразвукового исследований, массажа и других медицинских процедур.
Если Вы принимаете лекарства, обязательно предупредите об этом лечащего врача.
Источник
Метод определения
Real-time-PCR.
Исследуемый материал
Цельная кровь (с ЭДТА)
Расширенное исследование генов системы гемостаза: F2, F5, MTHFR, MTR, MTRR, F13, FGB, ITGA2, ITGВ3, F7, PAI-1
Комплексное исследование генетических факторов риска развития нарушений в системе свертывания крови и фолатном цикле (без заключения врача-генетика).
Различные изменения в генах системы гемостаза и цикла обмена фолатов предрасполагают к развитию большого числа патологических состояний: инфаркты, инсульты, тромбоэмболии, кровотечения, патология беременности и родов, осложнения послеоперационного периода и т.д. Профиль включает в себя исследование основных полиморфизмов в генах системы гемостаза и фолатного цикла:
- F2 c.*97G>A (20210 G>A; rs1799963),
- F5 c.1601G>A (Arg534Gln; 1691 G>A; rs6025),
- MTHFR c.665C>T (Ala222Val; 677 C>T; rs1801133),
- MTHFR c.1286A>C (Glu429Ala; 1298 A>C; rs1801131),
- MTR c.2756A>G (Asp919Gly; rs1805087),
- MTRR c.66A>G (Ile22Met; rs1801394),
- F13 с.103G>T (I63Т; rs5985),
- FGB c.-467G>A (-455 G>А; rs1800790),
- ITGA2 c.759C>T (Phe253Phe, 807 C>T; rs1126643),
- ITGB3 c.176T>C (Leu59Pro; 1565 T>C; rs5918),
- F7 c.1238G>A (Arg353Gln; 10976 G>A; rs6046),
- PAI-1 (SERPINE1) –675 5G>4G (rs1799889).
Ген F2 кодирует аминокислотную последовательность белка протромбина. Полиморфизм F2 c.*97G>A приводит к повышенной экспрессии гена. Клинически неблагоприятный вариант полиморфизма (c.*97A) наследуется по аутосомно-доминантному типу. Наличие полиморфизма F2 c.*97G>A в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне курения — в 40 и более раз) увеличивает риск возникновения венозных тромбозов, в том числе тромбозов сосудов мозга и сердца, особенно в молодом возрасте. У пациентов-носителей данного полиморфизма повышен риск развития тромбоэмболий после хирургических вмешательств. Приём оральных контрацептивов у данной группы лиц также увеличивает риск тромбозов (относительный риск развития тромбофилии и венозной тромбоэмболии у гетерозиготных носительниц полиморфизма c.*97G>A возрастает в 16 раз).
Ген F5 кодирует аминокислотную последовательность белка проакцелерина — коагуляционного фактора 5. Нуклеотидная замена c.1601G>A («мутация Лейден») приводит к аминокислотной замене аргинина на глутамин в позиции 534, что придает устойчивость активной форме проакцелерина. Клинически это проявляется рецидивирующими венозными тромбозами и тромбоэмболиями. Наличие полиморфизма в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне заместительной гормонотерапии или приема оральных контрацептивов — в 30 и более раз) увеличивает риск венозных тромбозов. Риск инфаркта миокарда увеличивается в 2 и более раз, риск развития патологии беременности (прерывание беременности, преэклампсия, хроническая плацентарная недостаточность и синдром задержки роста плода) увеличивается в 3 и более раз.
Также, пациенты, являющиеся одновременно носителями полиморфизма c.*97G>A гена протромбина и «мутации Лейден», еще в большей степени подвержены риску развития тромбозов и тромбоэмболий.
Ген MTHFR кодирует аминокислотную последовательность фермента метилентетрагидрофолатредуктазы, играющего ключевую роль в метаболизме фолиевой кислоты. Полиморфизм c.665C>T гена MTHFR связан с заменой нуклеотида цитозина (С) на тимин (Т), что приводит к аминокислотной замене аланина на валин в позиции 222. Вариант c.665Т связан с четырьмя группами мультифакториальных заболеваний: сердечно-сосудистыми, дефектами развития плода, колоректальной аденомой и раком молочной железы и яичников. У женщин с генотипом c.665Т/Т дефицит фолиевой кислоты во время беременности может приводить к порокам развития плода, в том числе незаращению нервной трубки. Неблагоприятное воздействие варианта c.665Т- зависит от внешних факторов: низкого содержания в пище фолатов, курения, приема алкоголя. Сочетание генотипа c.665Т/Т и папилломавирусной инфекции увеличивает риск цервикальной дисплазии. Назначение препаратов фолиевой кислоты может значительно снизить негативное влияние данного варианта полиморфизма.
Полиморфизм MTHFR c.1286A>C связан с точечной заменой нуклеотида аденина (А) на цитозин (С), что приводит к замене аминокислотного остатка глутаминовой кислоты на аланин в позиции 429, относящейся к регулирующей области молекулы фермента. При наличии данного полиморфизма отмечается снижение активности фермента MTHFR. Это снижение обычно не сопровождается изменением уровня гомоцистеина в плазме крови у носителей дикого варианта полиморфизма c.665C>T, однако сочетание аллельного варианта* c.1286C с аллелем c.665T приводит к снижению уровня фолиевой кислоты и соответствует по своему эффекту гомозиготному состоянию MTHFR c.665Т/T. При этом риск развития дефектов нервной трубки повышается в 2 раза. Жизнеспособность плодов, имеющих одновременно оба полиморфных варианта, также снижена.
Ген MTR кодирует аминокислотную последовательность фермента метионин синтазы. Полиморфизм c.2756A>G связан с аминокислотной заменой (аспарагиновой кислоты на глицин) в молекуле фермента. В результате этой замены функциональная активность фермента изменяется, что приводит к повышению риска формирования пороков развития у плода. Влияние полиморфизма усугубляется повышенным уровнем гомоцистеина.
Ген MTRR кодирует аминокислотную последовательность фермента редуктазы метионинсинтазы. Полиморфизм c.66A>G связан с аминокислотной заменой в молекуле фермента. В результате этой замены функциональная активность фермента снижается, что приводит к повышению риска развития дефектов нервной трубки у плода. Влияние полиморфизма усугубляется дефицитом витамина В12. При сочетании полиморфизма c.66A>G гена MTRR с полиморфизмом c.665C>T в гене MTHFR риск spina bifida увеличивается. Полиморфизм c.66A>G гена MTRR усиливает гипергомоцистеинемию, вызываемую полиморфизмом c.665C>T в гене MTHFR.
Ген фибриназы (F13) кодирует синтез трансглютаминазы, участвующей в стабилизации фибринового сгустка и в формировании соединительной ткани. Аллельные варианты с.103G/Т и с.103Т/Т приводят к снижению уровня трансглютаминазы с образованием сетчатой структуры фибрина с более тонкими волокнами, меньшими порами, и изменением характеристик проникновения, которое в сочетании с другими факторами риска ассоциируется с возможным риском внутричерепных кровоизлияний и кровотечений из внутренних органов, а также привычным невынашиванием беременности. При этом аллельный вариант с.103Т может выступать в роли протективного фактора в отношении инфаркта миокарда и венозных тромбозов.
Ген FGB кодирует β-цепь фибриногена, являющегося предшественником фибрина. Аллельный вариант c.-467А обусловливает усиленную транскрипцию гена и может приводить к увеличению уровня фибриногена в крови и повышению вероятности образования тромбов при наличии дополнительных факторов риска. Гетерозиготный вариант c.-467G/А связывают с повышенным риском ишемического инсульта и лакунарными инфарктами церебральных сосудов. Гомозиготный вариант c.-467A/А связывают с повышенным риском инфаркта миокарда.
Ген гликопротеина Gp1a (ITGA2) кодирует синтез альфа-2-субъединицы интегринов – специализированных рецепторов тромбоцитов. Аллельный вариант c.759Т вызывает изменение первичной структуры субъединицы и свойств рецепторов. При гетерозиготном (c.759C/T) варианте отмечается увеличение скорости адгезии тромбоцитов к коллагену I типа, что может приводить к повышенному риску тромбофилии, инфаркта миокарда и других сердечно-сосудистых заболеваний. Аллельный вариант c.759Т связывают со случаями резистентности к аспирину. Помимо этого, при гомозиготном (c.759Т/T) варианте значительно увеличивается количество рецепторов на поверхности тромбоцитов. В совокупности, при гомозиготном варианте данного полиморфизма значительно повышен риск тромбофилии, инфаркта миокарда и развития других острых эпизодов тромбообразования в возрасте до 50 лет, даже по сравнению с гетерозиготным вариантом.
Ген гликопротеина Gp3a (ITGB3) кодирует синтез бета-3 цепи интегринового комплекса GP2b3a, участвующего в разнообразных межклеточных взаимодействиях (адгезии и сигнализации). Аллельный вариант c.176С (гетерозигота c.176T/C) обусловливает повышенную адгезию тромбоцитов и может приводить к увеличению риска развития острого коронарного синдрома, а также связан с синдромом привычного невынашивания беременности. Гомозиготный вариант c.176С/C обусловливает повышенную адгезию тромбоцитов и может приводить к значительному увеличению риска развития острого коронарного синдрома в возрасте до 50 лет. У лиц с полиморфными аллельными вариантами часто отмечается пониженная эффективность аспирина.
Аллельный вариант c.1238A (гетерозигота c.1238G/A и гомозигота c.1238А/A) гена F7 приводит к понижению экспрессии гена и снижению уровня фактора 7 в крови, рассматривается как протективный маркёр в отношении развития тромбозов и инфаркта миокарда.
Ген ингибитора активатора плазминогена (PAI-1) кодирует белок-антагонист тканевого и урокиназного активатора плазминогена. Преобладающим в популяции вариантом исследуемого полиморфизма является гетерозиготный вариант -675 5G/4G. В связи с этим данный полиморфизм самостоятельного диагностического значения не имеет, эффект возможно оценить в сочетании с другими факторами предрасполагающими к развитию патологии (например в сочетании с FGB c.-467A). Аллельный вариант -675 4G сопровождается большей активностью гена, чем -675 5G, что обусловливает более высокую концентрацию PAI-1 и уменьшение активности противосвёртывающей системы. Гомозигота -675 4G/4G ассоциирована с повышением риска тромбообразования, преэклампсии, нарушением функции плаценты и самопроизвольного прерывания беременности.
*Примечание: иногда в научной литературе при описании однонуклеотидных замен, характерных для генных полиморфизмов, встречается термин «мутантный аллель». Это терминологическая неточность, так как в классической генетике термин «мутантный аллель» традиционно рассматривается как синоним термина «мутация». При мутациях, как известно, изменение структуры гена приводит к образованию (экспрессии) нефункциональных белков и к неизбежному развитию наследственного заболевания. При полиморфизмах изменение в структуре гена приводит лишь к появлению белков с немного изменёнными физико-химическими свойствами. Такие изменения, как известно, проявляют себя при воздействии на организм различных факторов внешней среды или при изменении функционального состояния организма человека. И только в таких ситуациях функционирование белков со структурными особенностями может, либо способствовать ускорению развития заболевания, либо, напротив, тормозить формирование патологических процессов. Поэтому, на наш взгляд, для разграничения изменений в генах столь очень похожих структурно, но приводящих к несоизмеримо разным последствиям для организма, корректнее в отношении генных полиморфизмов применять понятие «аллельный вариант гена», а не «мутантный аллель».
Литература
- Никитина Л.А. и др. Роль некоторых генетических полиморфизмов в невынашивании беременности // Проблемы репродукции, 2007, С.83-89.
- Güngör et al. The presence of PAI-1 4G/5G and ACE DD genotypes increases the risk of early-stage AVF thrombosis in hemodialysis patients. // Ren Fail. 2011;33(2):169-7
- Wei YS, et al. Association of the integrin gene polymorphisms with ischemic stroke and plasma lipid levels // Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 2009;26(2):211-5
- Gohil et al., The genetics of venous thromboembolism. A meta-analysis involving approximately 120,000 cases and 180,000 controls // Thromb Haemost, 2009. 102(2): 360-70
- Goodman et al., Which thrombophilic gene mutations are risk factors for recurrent pregnancy loss? // Am J Reprod Immunol, 2006. 56(4):230-6
- Gerhardt, A., et al. The polymorphism of platelet membrane integrin alpha2beta1 (alpha2807TT) is associated with premature onset of fetal loss // Thromb Haemost, 2005. 93(1):124-9.
- Ruzzi, L., et al., Association of PLA2 polymorphism of the ITGB3 gene with early fetal loss // Fertil Steril, 2005. 83(2): 511-2
- База OMIM: https://omim.org/entry/176930
- База OMIM: https://omim.org/entry/227400
- База OMIM +227400 https://omim.org/entry/607093
- База OMIM: https://omim.org/entry/602568
- База OMIM: https://omim.org/entry/156570
- https://www.ncbi.nlm.nih.gov/clinvar/RCV000012861/
Источник