Метамиелоциты и миелоциты в анализе крови что это

© Автор: З. Нелли Владимировна, врач лабораторной диагностики НИИ трансфузиологии и медицинских биотехнологий, специально для СосудИнфо.ру (об авторах)
Миелоциты – клетки-предшественники взрослых гранулоцитов (лейкоцитов гранулоцитарного ряда), прошедшие через стадии миелобласт – промиелоцит -миелоцит (дальнейшая форма – метамиелоцит). Миелоциты – последние из гранулоцитов, обладающие способностью к пролиферации и делению. В норме как миелоциты, так и их предки миелобласты и промиелоциты и незрелые потомки – метамиелоцитыприсутствуют только в костном мозге. Поэтому даже минимальное значимое содержание таких клеток в анализе крови, скорее всего, говорит о патологии.

стадии роста миелоцита – от миелобласта до взрослого лейкоцита гранулоцитарного ряда (нейтрофила, базофила или эозинофила)
Миелоциты в крови? Услышав подобный вопрос из уст пациента, врач, наверное, удивленно поднимет брови и ответит: «Нет, в норме эти клетки в периферическую кровь не выходят, их место – костный мозг, там они зарождаются, там дифференцируются и созревают».
Самым молодым представителем форменных элементов, которые называются белыми клетками крови или лейкоцитами, является клетка паренхимы костного мозга – миелобласт. Среднее время дифференцировки от миелобласта до зрелого лейкоцита гранулоцитарного ряда – гранулоцита (в основном это сегментоядерные нейтрофилы) составляет порядка 8 – 10 суток. От клеток-предшественниц (миелоцитов), которым посвящена данная публикация, «бабушек» зрелых гранулоцитов, до сегментированных лейкоцитов – 48 – 50 часов «ходу».
В периферической крови – в норме только зрелые формы
Основные органы кроветворения – костный мозг, селезенка и лимфатические узлы к завершению внутриутробного развития и появлению человека на свет окончательно приобретают свою специализацию. Лимфоузлы и селезенка обеспечивают поддержание циркулирующего фонда лимфоцитов (лимфоцитопоэз), а костный мозг полностью отвечает за образование форменных элементов миелоидного и эритроидного ряда – эритроцитов (эритропоэз), моноцитов (моноцитопоэз), тромбоцитов (тромбоцитопоэз), а также диффренцировку и созревание гранулоцитов – зернистых белых клеток крови (гранулоцитопоэз), наиболее многочисленной группы в популяции лейкоцитов.

общая схема гемопоэза
Лейкоциты в периферической крови представлены только зрелыми клетками: уже названными зернистыми потомками миелоцитов – гранулоцитами, а также незернистыми – агранулоцитами (моноциты, лимфоциты)
Гранулоциты, в свою очередь, делят на:
- Нейтрофилы (сегментоядерные: 47-72% в крови и палочкоядерные: 1-6%) – зрелые, высокоспециализированные клетки, обладающие выраженной защитной способностью (фагоцитоз) и высокой двигательной активностью, чем объясняется их значительная численность в группе лейкоцитов гранулоцитарного ряда. В крови их большинство, соответственно и связь их с предками-миелоцитами максимальна;
- Эозинофилы (0,5-5% в крови) – фагоцитарная и двигательная активность у них ниже, чем у нейтрофилов, основная задача – участие в аллергических реакциях;
- Базофилы (0-1% в крови) – немногочисленная группа, имеющая прямое отношение к аллергии и участвующая в процессах свертывания крови.

лейкоциты гранулоцитарного ряда – потомки миелоцитов
Очевидно, о том, что происходит с клетками до их выхода в кровеносное русло, кровь здорового человека ничего не сообщает: все спокойно, «взрослые» зернистые лейкоциты, находясь в пределах своих нормальных значений, незаметно выполняют возложенные на них важные функции. Нарушения можно заподозрить при проведении качественного гематологического анализа образцов крови больного человека.
Обнаружение несвойственных периферической крови пролиферирующих представителей гранулоцитарного ряда (миелобластов, промиелоцитов, миелоцитов) и созревающих клеток (метамиелоцитов или юных, также не дошедших до стадии полного созревания) может указывать на серьезную гематологическую патологию.
Место «рождения», деления и дифференцировки – костный мозг
Пул зернистых лейкоцитов берет свое начало в костном мозге от полипотентных стволовых клеток. Продвигаясь в своем развитии от класса к классу через сравнительно небольшое количество унипотентных клеток-предшественниц, будущие лейкоциты доходят до морфологически различимых пролиферирующих форм – бластов (миелобласт), которым впоследствии предназначено стать полноценными «взрослыми» нейтрофилами, эозинофилами, базофилами (при условии, что кроветворение идет в нормальном режиме). По мере созревания миелобласт через стадию промиелоцита дифференцируется в последнюю клетку гранулоцитарного (зернистого) ряда, которая оставляет за собой способность к делению и дифференцировке – миелоцит.

Миелоцит в костном мозге существует в виде двух генераций: клетки, которые размерами побольше – материнские, поменьше – дочерние. Считается, что материнские клетки утрачивают способность к пролиферации и дифференцировке, а вот дочерние обладают подобными возможностями и, пройдя стадию метамиелоцитов (юных) и палочкоядерных, на законных основаниях направляются в кровь, чтобы циркулировать по кровеносным сосудам и выполнять важные для организма задачи – обеспечивать первичную противоинфекционную защиту, фагоцитируя («поедая») попавшие извне микроорганизмы. То есть, прежде чем миелоцит превратится в полноценный «взрослый» нейтрофил, должна последовать еще одна стадия созревания – метамиелоцит.
Метамиелоциты называют юными, они иной раз попадают в норме в периферическую кровь, но количество их мизерно по сравнению с клетками, достигшими зрелости. Кроме этого, в периферической крови встречаются (в небольшом количестве, норма – до 6%) клетки по своим характеристикам максимально приближающиеся к зрелым формам, это – палочкоядерные гранулоциты. Палочки постарше метамиелоцитов (юных), однако, все же сохраняя признаки «молодости», они еще неспособны взять на себя столь ответственные задачи, которые входят в компетенцию сегментоядерных нейтрофилов, поэтому по отношению к сегментам они – молодые и количество их в анализе в норме совсем не велико. Вот и оказывается, что все не так просто:
При нормальных условиях миелоцитам в больших количествах добраться до крови практически не удается, разве что единичные случайно могут просочиться. Поэтому повышение любое заметное появление миелоцитов происходит только при патологии.
«Незаконное» проникновение в периферическую кровь
Однако бывают ситуации, когда клетки, которым надлежит еще «расти и развиваться» преждевременно покидают «родные пенаты». И если в норме о появлении бластных клеток в периферической крови не может быть и речи – они редкие «гости» в кровеносном русле, то при определенных патологических состояниях, вопреки природному запрету, и те, и другие все же выходят в кровеносное русло.
Бласты и миелобласты несколько повышены (до 2% по отношению к общей популяции лейкоцитов) при хронических формах лейкозов. А огромное количество бластов (бластемия) вообще указывает на серьезные изменения со стороны органов кроветворения и относится к значимым признакам острого лейкоза, форма которого будет впоследствии уточняться другими методами.
Особую обеспокоенность вызывает переход количества бластов 5% границы в крови больного, страдающего хроническим миелолейкозом – это может свидетельствовать о начале бластного криза и финальной стадии опухолевого процесса.

миелобласты в крови
Присутствие пропромиелоцитов, миелоцитов и наиболее приближенных к зрелым формам – метамиелоцитов, хоть и не является столь страшным показателем белой крови, однако все же указывают на серьезную патологию. Увеличение количества этих клеток до 5% чаще имеет причиной негематологическую патологию:
- Тяжело протекающее инфекционное заболевание любого происхождения: и бактериального (в основном), и вирусного;
- Развитие септического состояния;
- Различного рода интоксикации (бактериальная, алкогольная, солями тяжелых металлов);
- Опухолевый (злокачественный) процесс;
- Химио- и лучевая терапия;
- Прием отдельных лекарственных препаратов (анальгетики, иммуномодуляторы);
- Острые кровопотери;
- Кома, шок;
- Нарушение кислотно-щелочного равновесия;
- Чрезмерная физическая нагрузка.

присутствие миелоцитов и метамиелоцитов в крови
Между тем, значительный скачок миелоцитов, про- и мета- (до 10 – 25%), как правило, наблюдается в случае формирования миелопролиферативных заболеваний, которые и являются самыми основными причинами выхода из костного мозга созревающих форм и их свободного передвижения по кровеносным сосудам.
«Молодые да ранние»…
Под собирательным названием «миелопролиферативные опухоли» понимают хронические лейкозы, которые формируются на уровне самых молодых предшественников миелопоэза, все потомство которых – гранулоциты, моноциты, эритрокариоциты, мегакариоциты (кроме лимфоцитов), относится к опухолевому клону.

Хронический миелолейкоз, открывая список миелопролиферативных процессов, выступает в качестве типичного представителя опухолей, которые возникают из ранних (очень молодых) предшественников, миелопоэза дифференцирующихся до зрелого состояния.
Клеточный субстрат миелолейкоза берет начало от белого ростка кроветворения и представлен переходными (созревающими) формами гранулоцитов, в основном, нейтрофилов. Это говорит о том, что такие значимые клетки, как нейтрофилы, выполняющие столь важную роль в защите организма, страдают больше всех, поэтому понятно, почему это заболевание так плохо поддается лечению и, в конечном итоге, имеет летальный исход.
В начале болезни в крови отмечается сдвиг до миелоцитов и промиелоцитов, правда, численность их на первых порах еще незначительна. Помимо единичных промиелоцитов и несколько большего количества миелоцитов, в крови можно обнаружить представителей других клеточных популяций (эритрокариоциты, исчисляемые единицами, и высокий тромбоцитоз).
Развернутая стадия болезни дает значительное омоложение лейкоцитарной формулы и, при этом, кроме миелоцитов, в крови нередко повышены абсолютные значения и процентное содержание уже зрелых форм гранулоцитарного ряда: эозинофилов или базофилов (реже тех и других – «базофильно-эозинофильная ассоциация). Следует заметить, что резкое увеличение численности незрелых нейтрофилов является весьма и весьма неблагоприятным признаком, усложняющим течение болезни и прогноз.
Оценка состояния костного мозга
Очевидно, что слово «норма» может применяться только по отношению к костному мозгу, ибо миелоциты в крови априори присутствовать не могут. И повышены они там только в силу определенных причин, а не просто так. Поэтому далее – о месте миелоцитов в костном мозге.

В настоящее время биопсия костного мозга и его исследование (цитологический анализ) является обязательной процедурой при подозрении на развитие гематологической патологии. Морфологические характеристики костного мозга после тестирования сопоставляют с показателями периферической крови.
Следует заметить, что при исследовании костного мозга (миелограмма) врачи обе генерации миелоцитов рассматривают вместе, не разделяя их на дочерние и материнские, поскольку подобное разделение не имеет абсолютно никакого значения ни для нормы, ни для патологии.
Норма миелоцитов в костном мозге составляет от 7 до 12,2%. О нормах других участников кроветворения, взявшего начало от белого ростка, поможет рассказать нижеприведенная таблица.
Таблица: клеточный состав костного мозга в норме (белый росток кроветворения)
| Элементы костного мозга | Границы нормальных значений,% | Средние значения,% |
|---|---|---|
| Ретикулярные клетки (клетки ретикулярной стромы) | 0,1 – 1,6 | 0,9 |
| Бласты | 0,1 – 1,1 | 0,6 |
| Миелобласты | 0,2 – 1,7 | 1,0 |
| Нейтрофилы: — промиелоциты — миелоциты — метамиелоциты — палочкоядерные — сегментоядерные | 1,0 – 4,1 7,0 – 12,2 8,0 – 15,0 12,8 – 23,7 13,1 – 24,1 | 2,5 9,6 11,5 18,2 18,6 |
| Все нейтрофильные элементы | 52,7 – 68, 9 | 60,8 |
| Индекс созревания нейтрофилов | 0,5 – 0,9 | — |
| Эозинофилы (все генерации) | 0,5 – 5,8 | 3,2 |
| Базофилы | 0 – 0,5 | 0,2 |
| Лимфоциты | 4,3 – 13,7 | 9,0 |
| Моноциты | 0,7 – 3,1 | 1,9 |
| Плазматические клетки | 0,1 – 1,8 | 0,9 |
Базофильные и эозинофильные миелобласты в здоровом костном мозге, как правило, не определяются (их трудно распознать), зато становятся довольно заметными при высокой эозинофильной реакции или хроническом миелолейкозе. Примерно то же самое происходит и с промиелоцитами – больше всех себя проявляют молодые клетки, которые стремятся стать нейтрофилами.
Что касается миелоцитов (эозинофильных, базофильных и нейтрофильных), то здесь ситуация несколько меняется, если к главному органу кроветворения нет претензий. Эозинофильный миелоцит, хотя ядром и похож на нейтрофильный, но отличается густой, заполняющей всю цитоплазму, зернистостью, базофильный миелоцит тоже легко распознается, он первым приобретает специфическую зернистость, которая негусто покрывает цитоплазму. При зарождении патологического процесса в костном мозге представители 3 генераций миелоцитов трудно различимы между собой и все напоминают нейтрофилы.
На стадии метамиелоцита, клетки уже «определились» в своей «профессии», поэтому специалисту, знающему их особенности и основные черты, нетрудно понять «кто есть кто». Между тем, описание ядра, цитоплазмы и других характеристик вряд ли заинтересует читателя, во всем этом трудно разобраться, тем более, если рядом нет микроскопа и клетку нельзя увидеть воочию. Поэтому не стоит попусту тратить время, более полезно будет рассказать о тех ситуациях, которые действительно могут волновать человека, например, о появлении миелоцитов у ребенка или их присутствии при беременности у женщины.
Миелоциты у детей и беременных женщин?
Почему-то многие считают, что появление миелоцитов и других, находящихся в стадии созревания, форм чуть ли не норма у женщин при беременности или у ребенка младшего возраста… Состав крови (морфологические характеристики) действительно зависят от пола и возраста, однако все это касается лишь красной крови (гемоглобин выше у мужчин, СОЭ выше у женщин), в лейкоцитарной формуле половые и возрастные отличия можно обнаружить в количественном плане (постепенно падает уровень лейкоцитов, но увеличивается содержание лимфоцитов).

Вариационное распределение показателей (эозинофилы, палочки, СОЭ, ретикулоциты) может проявлять некоторую ассиметрию и расширять границы нормальных значений. И все это касается, в первую очередь, детей и женщин, пребывающих в состоянии, вполне физиологическом – вынашивании ребенка. Однако о наличии миелоцитов в периферической крови этой категории людей в качестве нормы – речи просто быть не может: клетки в состоянии миелоцита не принадлежат к популяции нормальных показателей белой крови (периферической, разумеется).
Появление в крови любых незрелых форм гранулоцитов (миелоциты, миелобласты, промиелоциты юные) указывает на то, что костный мозг начал активную деятельность по производству новых клеток. Возможно, они нужны для борьбы с каким-то инфекционным агентом, незаметно проникшим в организм? Возможно. Кроме того, также возможно, что при беременности, нормально протекающей, это обусловлено усилением процессов кроветворения, ведь перестроившиеся под вынашивание плода системы жизнеобеспечения (в том числе, и система кроветворения) женщины начинают нести большую, чем раньше, нагрузку.
И все же при беременности допустимым считается уровень миелоцитов, не превышающий 3%. Но то, что выше – требует тщательного всестороннего анализа. Однако и здесь, прежде чем ставить себе диагноз (миелолейкоз), нужно вспомнить, нет ли в организме хронических процессов (например, тонзиллит), которые могут обостряться при беременности тоже.
Присутствие миелоцитов у ребенка также может свидетельствовать о проникновении инфекции и активной борьбе «взрослых» клеток с ней. В любом случае – подобные вопросы должны найти ответы у врача.
Рекомендации читателям СосудИнфо дают профессиональные медики с высшим образованием и опытом профильной работы.
На ваш вопрос ответит один из ведущих авторов сайта.
В данный момент на вопросы отвечает: А. Олеся Валерьевна, к.м.н., преподаватель медицинского вуза
Поблагодарить специалиста за помощь или поддержать проект СосудИнфо можно произвольным платежом по ссылке.
Источник
Все клетки крови условно можно подразделить их на грануцлоциты и агранулоциты.
Первые имеют в структуре ядро, также некоторые другие включения. Вторые гомогенны по внутреннему строению, обеспечивают иные функции.
Миелоциты — это незрелые предшественники гранулоцитов. Чтобы лучше понять что к чему, стоит обратиться к микробиологическим знаниям.
Что такое миелоциты и их виды
Предшественником абсолютно любой клетки крови считается особая стволовая клетка. Она обладает двумя важными особенностями:
- Способна превратиться в любую другую цитологическую структуру. То есть дифференцироваться.
- Не погибает после некоторого числа делений. Как это случается с обыкновенной, функционально определенной клеткой.
В специальных структурах, известных как отростки костного мозга, происходит дифференциация цитологических единиц. Миелоциты в крови — это особые промежуточные клетки, уже не стволовые, но еще и не функционально активные. В норме в анализе их быть не должно.
Допустимы некоторые исключения. Например, при приеме препаратов, угнетающих гемопоэз. Но это скорее редкие возможные случаи, а не закономерные изменения и процессы.
На первой стадии стволовые клетки дифференцируются на два вида:
- Материнские миелопоэтические. Из них образуются собственно сами гранулоциты, но не сразу. То есть клетки, которые в основном отвечают за иммунный ответ. Также из этих структур появляются эритро — и тромбоциты.
- Материнские лимфопоэтические. Как и следует из названия, в результате дальнейшего созревания образуются лимфоциты — агранулоцитарные разновидности иммунных клеток.
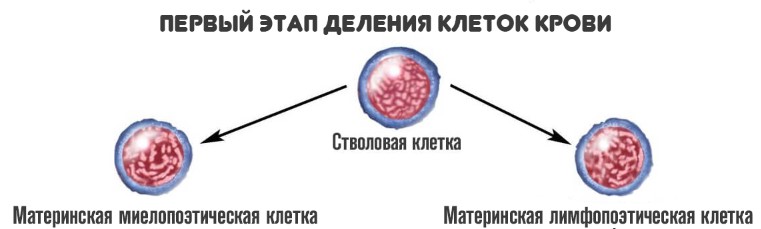
На второй стадии из миелопоэтической клетки появляется три новых вида более зрелых вариантов:
- Эритробласт. Из него формируются эритроциты.
- Мегакариобласт. Предшественник тромбоцитов.
- Миелобласт. Из него образуются все гранулоциты.
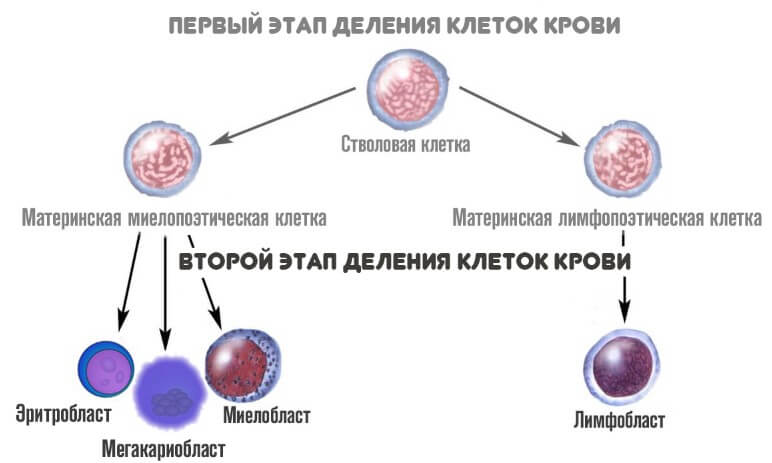
На третьем этапе из миелобласта появляется промиелоциты и затем миелоциты, о которых идет речь. Если рассматривать схему более подробно, то миелоцитов существует три типа: нейтрофильные, базофильные и эозинофильные.
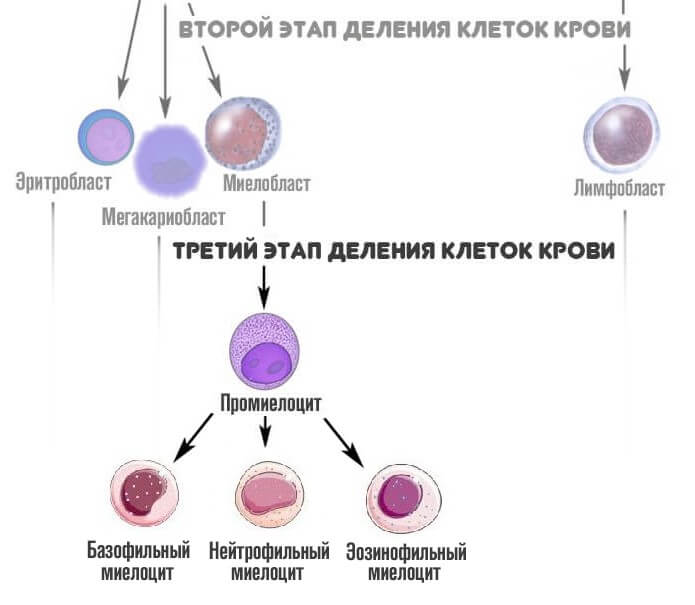
На следующей стадии, миелоциты делятся на метамиелоциты это предшественники гранулоцитов, особых клеток иммунной системы человека, которые участвуют в работе защитных сил тела.
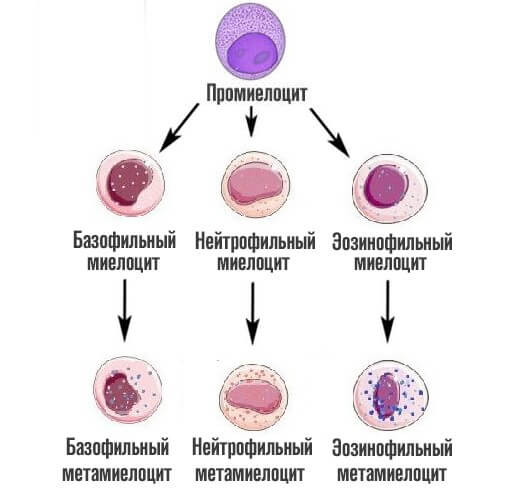
Как только заканчивается эта стадия, начинается финальная. Из предшественниц цитологических структур образуется 3 вида лейкоцитов — клеток миелоидного ряда.
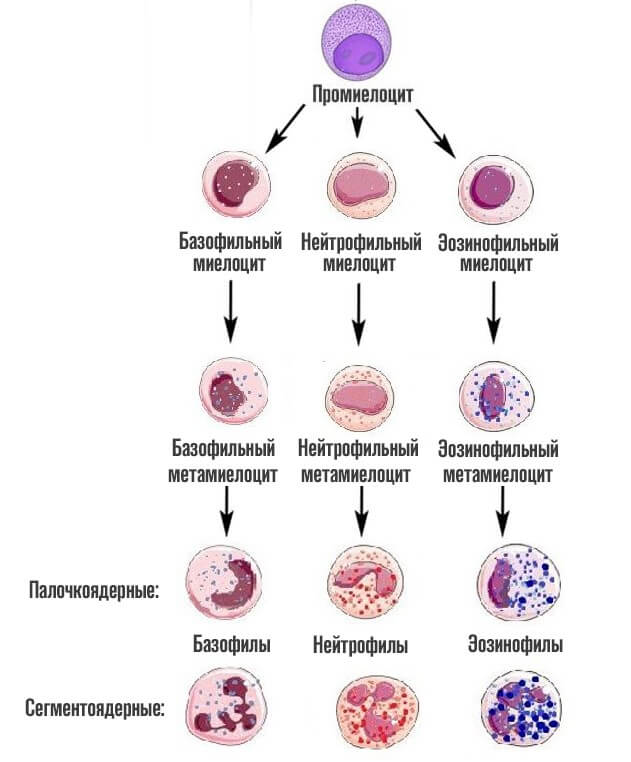
Базофилы
Наиболее крупные белые клетки крови. Намного больше прочих из названной группы. Обладает способностью инактивировать бактерии и вирусы. Это происходит благодаря особому строению клетки.
- С одной стороны, она способна к фагоцитозу. То есть поглощению инородного объекта.
- С другой — выделяет гистамин и прочие токсические вещества в окружающую среду для уничтожения инородных агентов.
- С третьей — несет на себе особые иммуноглобулины, которые подавляют развитие бактерий и вирусов.
Базофилы играют основную роль в аллергических реакциях. В крови всего около 1% от общей массы гранулоцитов.
Эозинофилы
Имеют округлую форму и сдвоенное ядро в виде перемычки. Как и названные выше клетки, обладает способностью к фагоцитозу. Однако основная функция эозинофила — противопаразитарная.
Благодаря особому строению наружной мембраны, цитологическая структура прилипает к личинкам гельминтов и растворяет их. Это главная задача, однако не единственная.
Как и базофилы, клетки способны бороться с вирусами и бактериями. Созревают они порядка 12 часов, после чего выходят в кровеносное русло. Это отличает их от предыдущих структур, которым нужно почти двое суток на «подготовку».
Эозинофилия также часто указывает на аллергию. Количество цитологических структур этого типа — почти 5%.
Нейтрофилы
Наиболее многочисленные. Составляют по разным оценкам, до 80% от общей массы гранулоцитов. Есть и другие выкладки. По всей видимости, разночтения связаны с динамикой процесса кроветворения, созревания клеток. Вариантов несколько.
Сами по себе нейтрофилы неоднородны. В кровеносном русле обнаруживаются их модификации. В том числе незрелые. Либо же сегментоядерные, палочкоядерные.
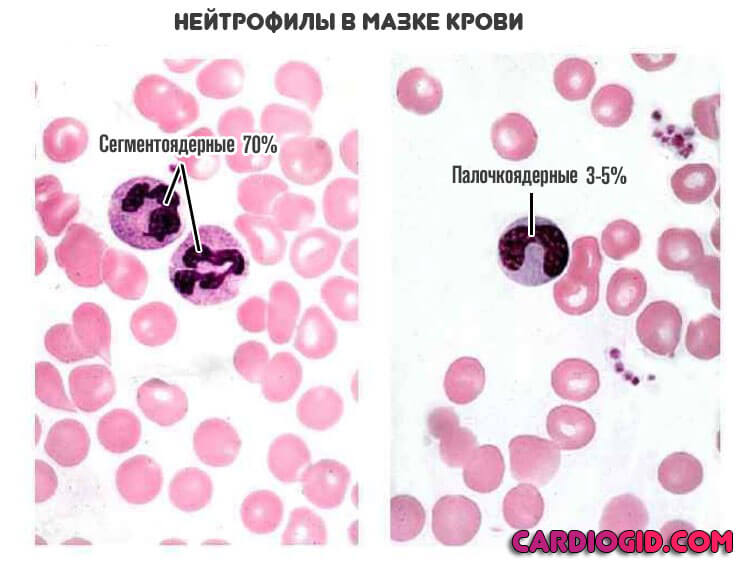
Они выполняют разные функции, но оба поглощают и переваривают чужеродные структуры. Это так называемый микрофагоцитоз.
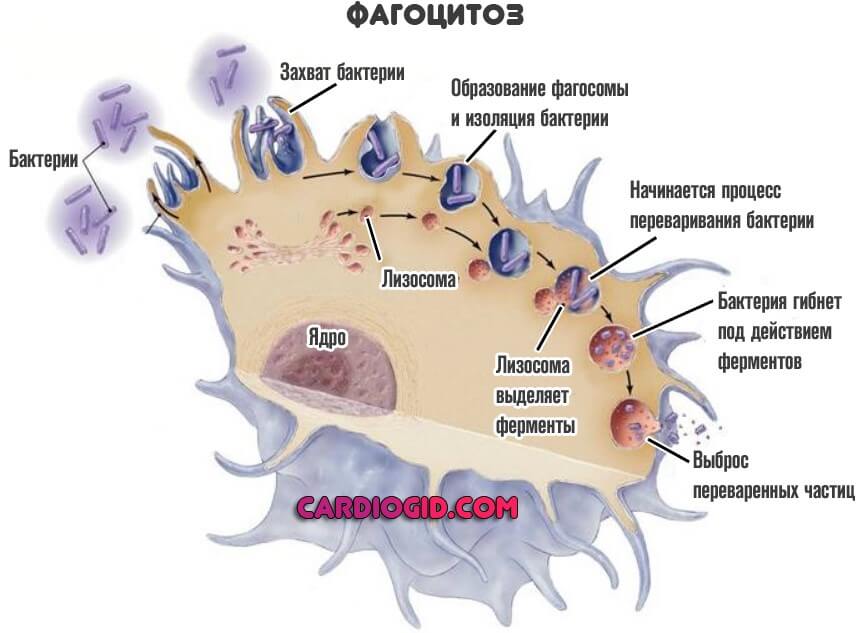
Примерная продолжительность жизни нейтрофилов составляет 12 дней. Плюс-минус.
Подробнее о нормах и причинах отклонений концентрации нейтрофилов в крови читайте здесь.
Норма содержания миелоцитов в крови
Обычно миелоциты отсутствуют в организме человека. Их быть не должно. В крайнем случае возможны погрешности на уровне 0.3-0.5% от общей массы клеток. Но чаще всего отклонения связаны с патологическими процессами.
О нормах можно говорить скорее в отношении зрелых клеток. Нейтрофилов, базофилов, эозинофилов и гранулоцитов в общем.
Причины повышения
Факторов роста показателей может быть довольно много. Вот лишь некоторые из возможных виновников.
Острые инфекционные процессы
Не важно какого плана, бактериальные, вирусные или грибковые. Сопровождаются соответствующей симптоматикой. Иногда протекают без проявлений. Почему в этом случае растет концентрация предшественников, незрелых клеток?
Причина простая — организм стремится как можно быстрее справиться с нарушением. Локализовать участок, отграничить его от прочих и побороть инфекцию.
Для этих целей синтезируется много нейтрофилов и иных структур. Но при столь активной работе ткани дают сбой, часть незрелых цитологических единиц поступает в кровеносное русло.
Лечение. Нужна ли терапия именно этого процесса? Нет, по мере выздоровления кроветворение перейдет в нормальное состояние. Все вернется на круги своя.
Важно скорректировать основной патологический процесс — собственно инфекционное заболевание. Для этой цели применяются антибиотики, противовирусные.
Если всему виной грибковые агенты — то фунгициды. Также противовоспалительные нестероидного происхождения (глюкокортикоиды угнетают иммунитет), антипиретики, чтобы сбить жар. Например, Нурофен, Ибупрофен. Важно обратиться к врачу за назначением курса терапии.
Длительность коррекции — около 2 недель в среднем. Плюс-минус. Постепенно все придет в норму само. Специальной терапии чрезмерной выработки предшественников не требуется.
Опухоли
В основном злокачественные, с распадом тканей аномальной структуры. Как правило, речь идет о запущенных стадиях патологического процесса.
Раковые клетки крайне прожорливы. Питания на всех уже не хватает. В определенный момент начинается гибель цитологических структур от недоедания. Все токсины выходят в кровеносное русло.
Иммунитет направляет к месту поражения «уборщиков», которые поглощают аномальные мертвые клетки. Однако, по мере прогрессирования заболевания, количество цитологических структур становится все больше.
Отсюда необходимость направлять дополнительные силы на борьбу с этим «мусором».
Появление промиелоцитов и миелоцитов в крови — результат гиперфункции костного мозга, в определенный момент он просто перестает справляться и выпускает в кровеносное русло незрелые клетки.
Лечение. Как и в предыдущем случае, нужно скорректировать основной патологический процесс — раковую опухоль. Здесь есть несколько вариантов.
Золотой стандарт — хирургическое вмешательство. Врачи удаляют неоплазию. Затем, по потребности, назначают химио— и лучевую терапию. Не всегда они эффективны, потому вопрос решает онколог. На месте.
Некроз тканей
Проще говоря, отмирание клеток. Происходит примерно тот же процесс, что и при раке. Только на сей раз гибнут не аномальные злокачественные, а вполне нормальные клетки, например, при массивных ожогах, гангрене.
Организм в миг встречается с потребностью как можно скорее удалить «мусор» из кровеносного русла. Это задача нейтрофилов, базофилов — гранулоцитов. Однако их недостаточно, приходится в авральном порядке вырабатывать новые. Наступает общий сбой.
Лечение. Необходимо как можно быстрее удалить отмершие клетки.
- В случае с гангреной — хирургическим путем.
- При ожогах применяют специальные растворы и мази, чтобы быстрее справиться с нарушением.
После этого в течение нескольких дней концентрация миелоцитов в крови должна быть около нуля или чуть больше. Незначительные погрешности также допустимы.
Анемия
Развивается при недостаточном поступлении железа, витаминов B9, B12. Последние две формы называются мегалобластными. Причина довольно простая. Чтобы клетки крови нормально созревали, им нужны эти вещества.
Если концентрация, поступление недостаточны, кроветворение сначала замедляется, а затем переходит в аномальный формат. Именно об этом и идет речь.
Мегалобласты или миелоциты составляют значительную часть от общей массы клеток. Такого быть, конечно же, не должно. Чем более запущен процесс, тем серьезнее обстоит дело с патологией.
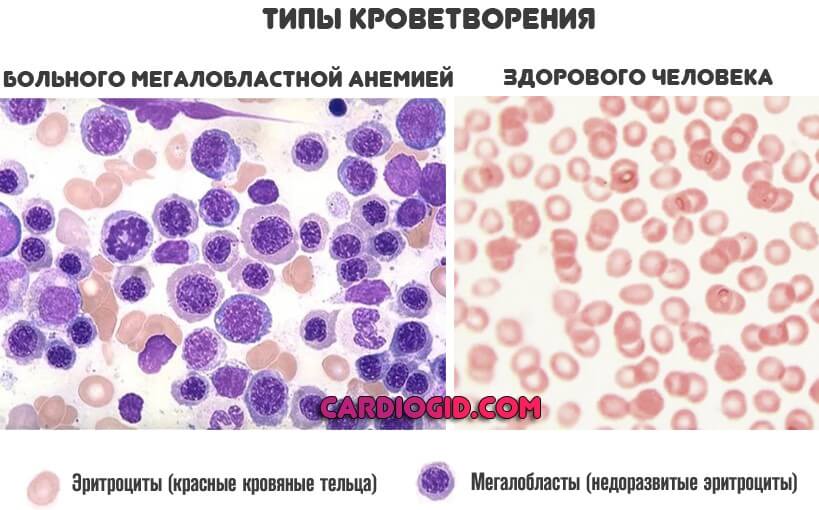
Лечение. Показаны ударные дозы витаминов группы B. По крайней мере, в течение нескольких недель. Вопрос сложный.
Иногда расстройство сопровождает заболевания пищеварительного тракта. В таком случае нужно лечение основной болезни. Иначе, как только концентрация витаминов снизится или их перестанут вводить, заболевание вернется на круги своя. Полумер недостаточно.
Отравления
Как правило, речь идет о бытовых расстройствах. Например, интоксикации этанолом. Реже тот же эффект происходит после приема дозы наркотиков опиоидного и каннабиоидного ряда.
Опасны синтетические, кустарные психоактивные вещества. Серьезные изменения картины крови наблюдаются у пациентов с приличным стажем приема всякого химического непотребства. Но не только.
Изначально высокие показатели наблюдаются у детей и подростков, склонных к наркомании, алкоголизму.
Лечение простое. Достаточно отказаться от психоактивного вещества. Провести специальные детоксикационные мероприятия с инфузионными растворами и препаратами особой группы (Дисоль, Трисоль, специфический антидот Налоксон). Вопрос решают специалисты по наркологии.
Воздействие радиации на организм
Ионизирующее излучение крайне негативно сказывается на состоянии костного мозга. При этом достаточно даже небольшой дозы. В быту люди встречаются с таким опасным фактором, например, при проведении частых рентгенов или лечении рака.
Прочие возможные варианты — это работа на урановых приисках, атомной электростанции, особенно при нарушении техники безопасности. Возможны идентичные проблемы и у подводников.
Лечение заключается в том, чтобы быстрее устранить последствия облучения. Для этого используют препараты йода.
Также назначают специальную диету с высоким содержанием белка, жиров. Например, кисломолочные продукты. Необходимо устранить и сам фактор поражения.
Редкие, тяжелые инфекционные процессы
Стоят особняком среди прочих. Можно назвать такие патологии, как тиф, запущенные формы сифилиса, генитальные поражения, герпетического и иного планов. Сюда же относят расстройства вроде туберкулеза, ВИЧ, СПИДа.
Они вызывают длительно текущие, если не сказать перманентные (постоянные) изменения картины крови. Поскольку сами по себе эти патологии протекают тяжело с высоким показателями миелоцитов.
Чем запущеннее отклонение, тем хуже обстоит дело с концентрацией незрелых цитологических структур в организме. Потому нужно начинать лечение как можно раньше.
Незавершенные формы не способны выполнять функции гранулоцитов. То есть бороться с инфекцией. Значит серьезно снижается иммунитет. На фоне СПИДа — это фактический приговор.
Терапия зависит от самого заболевания. Назначают иммуномодуляторы, антибиотики широкого спектра действия. В случае с туберкулезом — речь идет о фторхинолонах.
Прием некоторых медикаментов
Таковых довольно много. Например, противовоспалительные нестероидного происхождения. Также гормональные лекарства типа Преднизолона и его более мощных «собратьев» по группе.
Негативно сказываются на состоянии крови иммуносупрессоры: обнаружение миелоцитов в анализах возможно после химиотерапии Метотрексатом и прочими препаратами.
Нужно ли в этом случае специальное лечение? Нет, как таковая терапия не требуется. Достаточно отказаться от конкретного фармацевтического средства и/или заменить его другим. Не столь опасным для иммунной системы.
Но вопрос этот должен решать врач, поскольку без квалифицированной оценки легко навредить себе. При покупке препаратов настоятельно рекомендуется проверить в аннотации, как лекарство влияет на кроветворную систему.
Беременность
Не патологический процесс, а вполне естественное явление. Тем не менее, от этого не становится легче. Проблема в том, что ближе к третьему триместру беременности, когда плод набирает силу, возможны нарушения работы кроветворной системы матери и появление миелоцитов и метамиелоцитов в анализах.
Это результат скрытых патологических процессов и проблем со здоровьем. Например, часто так сказывается недостаточное питание, неправильный рацион не обеспечивает организм витаминами B9, B12. Начинается мегалобластная анемия.
Вопрос лечения стоит обсудить с гинекологом, который ведет пациентку. В относительно легких случаях делать не нужно ничего.
В более опасных, когда на кону жизнь, необходимо применять препараты для стимуляции кроветворения. Возможно назначение витаминов курсом, чтобы поддержать организм.
Вопрос сложный, все зависит от ситуации. Золотое правило — главное, чтобы предполагаемая польза превышала возможный вред.
Повышенные физические нагрузки
Встречается рост миелобластов в крови у пациентов, которые занимаются интенсивными физическими нагрузками. Причина в этом случае — активное образование продуктов-метаболитов жизнедеятельности.
В подобной ситуации концентрация растут несущественно. Норма восстанавливается сама, в течение нескольких часов после физической нагрузки. Поэтому специального лечения не требуется.
Это не полный список причин. Лишь наиболее частые варианты. Появление метамиелоцитов в крови означает, что течет патологический процесс со стороны пищеварительного тракта, кроветворной системы, онкологического плана.
Вариантов может быть много. Вопрос решается посредством диагностики.
Дополнительные обследования
Миелоидные клетки в анвлизе крови обычно отсутствуют, это клиническая норма. Однако, если обнаружены отклонения, нужны специальные мероприятия. Важно проверить что к чему.
Для этого одного лишь исследования крови, ОАК — недостаточно. Стоит обратиться к гематологу и под его присмотром пройти группу обследований.
- Опрос пациента. Врач уточняет жалобы, фиксирует симптомы и затем выдвигает гипотезы, что это может быть.
- Сбор анамнеза. Чтобы изучить вероятное происхождение патологического процесса.
- Расширенный анализ крови. Необходим, чтобы выявить возможные воспалительные явления в организме. В основном инфекционного происхождения.
- Также не обойтись без биохимии. Она необх?

