Маркеры воспаления в биохимическом анализе крови
 Скорость оседания эритроцитов (СОЭ) — неспецифический лабораторный показатель крови, отражающий соотношение фракций белков плазмы. Раньше этот показатель носил название «реакция оседания эритроцитов» (РОЭ). Это одно и то же. Несколько фактов из истории изучения этого вопроса. В 1918 г. Fahraeus обнаружил, что скорость оседания эритроцитов изменяется у беременных, в последующем он выявил, что СОЭ изменяется также при многих заболеваниях. Вестергрен в 1926 г. и Уинтроп 1935 г. разработали методы, которые и сейчас используют в клинической практике для определения СОЭ.
Скорость оседания эритроцитов (СОЭ) — неспецифический лабораторный показатель крови, отражающий соотношение фракций белков плазмы. Раньше этот показатель носил название «реакция оседания эритроцитов» (РОЭ). Это одно и то же. Несколько фактов из истории изучения этого вопроса. В 1918 г. Fahraeus обнаружил, что скорость оседания эритроцитов изменяется у беременных, в последующем он выявил, что СОЭ изменяется также при многих заболеваниях. Вестергрен в 1926 г. и Уинтроп 1935 г. разработали методы, которые и сейчас используют в клинической практике для определения СОЭ.
Повторю, что СОЭ — это высокочувствительный, но неспецифичный и нестабильный показатель воспаления. На результаты определения СОЭ влияют возраст, пол, уровень фибриногена, ревматоидного фактора (РФ), анемия и другие факторы. Эту фразу следует понимать так, что повышение СОЭ укажет на наличие какого-то воспаления в организме (инфекционного или нет), НО не ответит на вопрос — КАКОЕ ИМЕННО ВОСПАЛЕНИЕ И ГДЕ?
На сегодняшний день рекомендуется международный метод определения СОЭ по Вестергрену как наиболее чувствительный.
Верхняя граница СОЭ в норме по Вестергрену зависит от возраста и пола, рассчитывается по формуле:
- для женщин СОЭ (мм/час)=(возраст в годах+10)/2;
- для мужчин СОЭ (мм/час) = (возраст в годах)/2
Теперь коснусь значения определения СОЭ у ревматологических больных. СОЭ рекомендовано определять у всех пациентов при подозрении на ревматологическое заболевание. Да и вообще определение СОЭ входит в «золотой стандарт» обследования при подозрении на множество различных заболеваний, как ревматических, так и других (инфекционных и нет).
Увеличение СОЭ служит лабораторным классификационным критерием ревматоидного артрита. Повышение СОЭ>50 мм/час является критерием гигантоклеточного артериита. Повышение СОЭ>35 мм/час является диагностическим признаком ревматической полимиалгии. Рекомендуемая кратность определения СОЭ при установленном диагнозе составляет 1 раз в 1-3 месяца.
 C-реактивный белок (СРБ) – классический острофазовый белок плазмы крови, который рассматривается как наиболее чувствительный лабораторный маркер инфекции, воспаления и тканевого повреждения. В зависимости от цели исследования определение концентрации СРБ проводится классическими и высокочувствительными методами. Классические методы количественного анализа СРБ в сыворотке крови (радиальная иммунодиффузия, иммунотурбидиметрия и иммунонефелометрия) предназначены для выявления повышенного уровня СРБ при остром воспалении и тканевом повреждении в пределах диапазона концентраций 5-500 мг/л.
C-реактивный белок (СРБ) – классический острофазовый белок плазмы крови, который рассматривается как наиболее чувствительный лабораторный маркер инфекции, воспаления и тканевого повреждения. В зависимости от цели исследования определение концентрации СРБ проводится классическими и высокочувствительными методами. Классические методы количественного анализа СРБ в сыворотке крови (радиальная иммунодиффузия, иммунотурбидиметрия и иммунонефелометрия) предназначены для выявления повышенного уровня СРБ при остром воспалении и тканевом повреждении в пределах диапазона концентраций 5-500 мг/л.
Высокочувствительный анализ СРБ (вчСРБ), основанный на усилении аналитической чувствительности иммунохимических методов (иммуноферментного, иммунотурбидиметрического и иммунонефелометрического) в 10 и более раз с помощью специальных реагентов, позволяет измерять концентрации СРБ ниже 5 мг/л и используется для оценки базального уровня вчСРБ и связанного с ним риска сердечно-сосудистых катастроф. Индивидуальная концентрация СРБ достаточно стабильна и не подвержена суточным изменениям.
Нормальный уровень СРБ у взрослых составляет менее 5 мг/л (однако значения, превышающие 3 мг/л, могут указывать на высокий риск развития сердечно-сосудистой патологии); у новорожденных (до 3 недель) – менее 4,1 мг/л; у детей – менее 2,8 мг/л.
Определение СРБ является полезным тестом для оценки активности патологического процесса у больных ревматическими заболеваниями. СРБ входит в критерии ревматоидного артрита. Увеличение концентрации СРБ может говорить о развитии рентгенологических изменений, свидетельствующих о тяжелом деструктивном поражении суставов при раннем ревматоидном артрите. Рекомендуемая кратность определения СРБ составляет 1 раз в 1-3 месяц.

Источник
Комментарии
Всероссийское научное общество кардиологов. Москва 2011
Предыдущий раздел | Содержание | Следующий раздел
15. Маркеры воспаления и гемостатические факторы
В настоящее время активно изучается роль маркеров воспаления и гемостатических факторов в развитии атеросклероза. Эти маркеры связаны с различными биологическими системами, такими как регуляция активности тромбоцитов, коагуляция, фибринолиз, эндотелиальная функция и воспалительный ответ. Помимо потенциальной значимости перечисленных маркеров в качестве предикторов ССЗ, была установлена тесная связь маркеров воспаления с ожирением и СД [213].
Воспаление – одно из основных патологических изменений, наблюдающихся при атеросклерозе артерий, включая наиболее ранние стадии, которые обусловливают формирование АСБ; кроме того, оно лежит в основе изменений, способствующих повреждению бляшки и образованию тромба. В эпидемиологических и морфологических исследованиях последних двух десятилетий были получены убедительные доказательства того, что уровень С-реактивного белка (СРБ) в плазме крови является признаком вялотекущего воспалительного процесса и неблагоприятным прогностическим фактором как у больных с острым коронарным синдромом, так и у здоровых лиц, не имеющих клинических проявлений ССЗ [214, 215]. Установлено, что маркеры активного воспаления тесно ассоциируются с развитием фатального и нефатального ИМ [216–219].
СРБ является высокочувствительным, но неспецифичным маркером воспаления и повреждения (таблица 14). Любое повреждение тканей, как вызванное травмой, так и связанное с воспалением, приводит к повышению уровня СРБ в плазме крови. Концентрация СРБ возрастает уже в первые 6–9 часов, достигая пика на 1–3 день с момента повреждения, и достаточно быстро снижается на фоне эффективного лечения или элиминации очага воспаления. Учитывая низкую специфичность СРБ для оценки риска нежелательных ССО, анализ рекомендуется проводить дважды с интервалом в 2 недели. Для анализа используется венозная кровь, которая берется независимо от приема пищи (у лиц с отсутствием нарушений обмена веществ). Если в одном из анализов уровни СРБ превышают 10 мг/л, следует исключить наличие инфекционных или воспалительных заболеваний и повторить измерение.
Таблица 14. Риск нежелательных ССО в зависимости от уровня СРБ
| Уровни С-реактивного белка | Риск нежелательных сердечно-сосудистых событий |
| <1 мг/л | Низкий риск |
| 1–3 мг/л | Умеренный риск |
| 3–10 мг/л | Высокий риск |
| >10 мг/л | Результат не может быть использован для оценки риска, так как повышение уровней высокочувствительного маркера воспаления может быть связано с травмой, инфекционным или воспалительным заболеванием |
Лечебные вмешательства, снижающие уровни СРБ:
- “Здоровая” диета с низким содержанием жиров, легкоусвояемых углеводов, богатая растительными волокнами;
- Снижение уровня общего ХС в крови;
- Снижение избыточной МТ;
- Регулярная аэробная физическая нагрузка умеренной интенсивности;
- Снижение повышенных уровней глюкозы в крови у больных СД;
- Снижение повышенного АД;
- Отказ от курения;
- Уменьшение употребления алкоголя;
- Прием статинов, тиазолидиндионов (росиглитазон, пиоглитазон), тиенопиридиновых производных (клопидогрель, тиклопидин), аспирина и противовоспалительных лекарственных средств.
Учитывая низкую специфичность СРБ, использование его как скринирующего метода для оценки кардиоваскулярного риска было бы в настоящее время преждевременно.
Другим заслуживающим внимания маркером воспаления является неоптерин. Неоптерин является высокоспецифичным и высокочувствительным маркером активации макрофагов, играющих важную роль на всех этапах формирования и развития АСБ. Повышение содержания неоптерина в биологических жидкостях – крови, моче, слюне свидетельствует об активации клеточного иммунитета. Несмотря на то, что неоптерин является маркером воспаления, его уровни слабо коррелируют с уровнями СРБ. В ряде исследований было показано, что повышенные уровни неоптерина у лиц с низкими уровнями ХС-ЛНП (Плацентарный фактор роста (PlGF), играющий роль первичного воспалительного медиатора неоангиогенеза, является маркером нестабильного течения атеросклероза. PlGF участвует в ключевых механизмах, приводящих к дестабилизации АСБ. Он способен инициировать неоангиогенез в артериальной стенке путем привлечения моноцитов/макрофагов и стимуляции клеток воспаления, эндотелиоцитов и гладкомышечных клеток к выбросу хемоаттрактантов, провоспалительных цитокинов и матриксных металлопротеиназ. Прогностическая значимость определения уровней PlGF изучалась в рамках ряда проспективных исследований. Так, в группе больных с острым коронарным синдромом, принимавших участие в исследовании CAPTURE, повышенные уровни PlGF достоверно предсказывали увеличение риска развития нефатального ИМ и сердечно-сосудистую смерть в течение ближайших 30 дней. Показано, что уровни PlGF не зависят от возраста и пола, ИМТ, среднего уровня систолического и диастолического АД, СД II типа, наличия в анамнезе перенесенного ИМ или нарушения мозгового кровообращения. Не выявлено зависимости между уровнями PlGF с уровнями СРБ и интерлейкина-6. Наблюдение в течение 2 лет показало, что выявление в крови больных ИБС уровней PlGF выше 20,5 пг/мл свидетельствует о более неблагоприятном прогнозе (смерть от ССЗ, нефатальный ИМ) по сравнению с больными с низкими (Недавно стало известно, что ассоциированный с беременностью протеин плазмы-А (PAPP-A), представляющий собой цинксодержащую металлопротеиназу, в изобилии продуцируется клетками АСБ, особенно нестабильной. У больных острым коронарным синдромом уровень PAPP-A выше, чем у больных стабильной стенокардией, и его определение в крови можно использовать в качестве предиктора неблагоприятного прогноза больных ИБС, который может оказаться более чувствительным маркером воспаления и предиктором нестабильности АСБ, чем тропонины и кардиоспецифические ферменты.
Результаты исследований свидетельствуют, что у практически здоровых лиц повышенные уровни РАРР-А предсказывают наличие эхогенных бляшек в сонных артериях. Уровни РАРР-А достоверно выше у больных с гиперлипидемией по сравнению с нормолипидемическими пациентами.
На сегодняшний день нет ответа на вопрос, является ли повышение уровней РАРР-А в крови больных следствием или одним из предикторов развития ОКС. Повышение уровней PAPP-A может иметь место еще до развития ОКС: у больных с так называемыми легкоранимыми АСБ в сонных артериях уровни PAPP-A в крови выше по сравнению с теми, у кого отмечаются только начальные признаки атеросклероза сонных артерий.
Таким образом, PAPP-A является биохимическим маркером, участвующим в патогенезе ИБС. Уровень PAPP-A в плазме крови коррелирует с выраженностью системного воспаления, он повышен у больных острым коронарным синдромом. У больных с более высокими уровнями PAPP-A отмечается менее благоприятный прогноз в течение 2 лет наблюдения.
До сих пор остается открытым вопрос, какова в действительности роль маркеров воспаления и гемостатических факторов в патогенезе ССЗ, насколько независимы они от других ФР и свидетельствует ли их динамика (например, СРБ и фибриногена) об изменении активности воспаления при атеросклерозе [219–220]. В ряде исследований было показано, что добавление “новых” ФР к уже существующим стандартным моделям оценки риска позволяет точнее предсказать вероятность развития ИБС и других ССЗ (в частности АГ и инсульта [219– 222]. Однако в настоящее время было бы преждевременным широко использовать СРБ и другие “новые” маркеры в рутинной практике кардиолога для оценки кардиоваскулярного риска.
Предыдущий раздел | Содержание | Следующий раздел
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
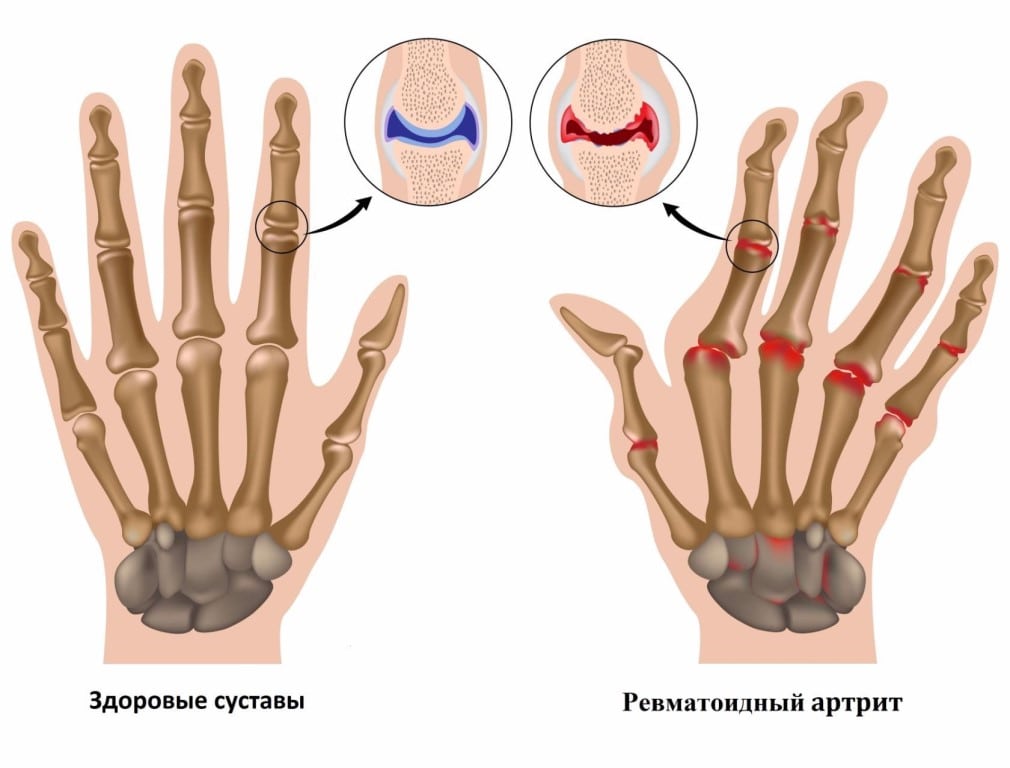
При подозрении на ревматоидный артрит (РА) проводится тщательное обследование пациента. Трудности при диагностировании патологии возникают из-за пока еще не установленных причин развития воспалительной реакции. Поэтому пациентам показан ряд лабораторных и инструментальных исследований, необходимых для выявления самого заболевания, стадии его течения, степени поражения суставных структур.

Ведущим диагностическим признаком РА считается ревматоидный фактор — специфические иммуноглобулины, вырабатываемые в процессе иммунного ответа. Но у более 20% больных серонегативной формой РА этого маркера суставной патологии в крови не обнаружено. При комплексном обследовании пациентов заболевание подтверждается анализами на антинуклеарный фактор, АЦЦП, С-реактивный белок. Биохимический анализ крови при ревматоидном артрите позволяет с максимальной точностью выявить аутоиммунную патологию.
Диагностические критерии
Важно знать! Врачи в шоке: «Эффективное и доступное средство от боли в суставах существует…» Читать далее…
Для ревматоидного артрита характерны эрозивно-деструктивные поражения преимущественно мелких периферических суставов. Заболевание опасно постепенным разрушением сочленений, расстройствами работы внутренних органов. Снижение их функциональной активности можно отследить по изменению состава биологических жидкостей — крови, мочи, синовия. Часто биохимические исследования помогают окончательно выставить диагноз «ревматоидный артрит», подтвердив результаты рентгенографии, МРТ, КТ, артроскопии. При подозрении на развитие патологии необходимо проведение следующих анализов:
- общего анализа мочи;
- общего анализа крови, включая подсчет СОЭ (скорость оседания эритроцитов);
- биохимический анализ крови для установления уровней печеночных ферментов, креатинина, С-реактивного белка;
- обнаружение ревматоидного фактора, антицитруллиновых и антинуклеарных антител;
- выявления маркеров развития гепатитов в качестве дифференциальной диагностики реактивных артритов.
Это самые распространенные методы клинического выявления заболевания суставов. Диагностика ревматоидного артрита по лабораторным анализам одновременно позволяет оценить общее состояние здоровья.
Клинические анализы крови, мочи, кала
Общий анализ крови при артрите позволяет установить ее качественный и количественный состав, физико-химические свойства. Обнаружение некоторых биохимических субстратов помогает определить протекающий в организме воспалительный процесс, в том числе спровоцированный патогенными микроорганизмами.
| Исследования крови, назначаемые при подозрении на развитие ревматоидного артрита | Характерные особенности диагностических мероприятий |
| Определение уровня лейкоцитов | Состояние, при котором в крови повышается количество лейкоцитов. Такое изменение состава крови выявляется при тяжелом течении ревматоидного артрита с присутствием внесуставной симптоматики. Обычно лейкоцитоз выявляется одновременно с повышенным уровнем ревматоидного фактора и служит показанием для назначения пациенту глюкокортикостероидов. Большое количество лейкоцитов в системном кровотоке может быть признаком инфицирования вирусами, бактериями, грибками, что требует дифференциальной диагностики |
| Установление содержания гемоглобина | С помощью этого критерия можно оценить активность РА. Выявляется анемия только у 50% больных. Причина резкого снижения гемоглобина — воспалительный процесс, негативно сказывающийся на состоянии иммунитета. Железодефицитная анемия выявляется несколько реже, требует дифференциальной диагностики для исключения внутренних кровотечений |
| Выявление концентрации лимфоцитов | Повышенный уровень лимфоцитов при одновременном снижении количества лейкоцитов — типичный маркер вирусной инфекции. Подтверждения — увеличение лимфатических узлов, клинические проявления общей интоксикации организма. Такое изменение состава крови характерно для реактивного артрита, спровоцированного проникновением в суставные полости возбудителей гепатита |
Самый информативный анализ для диагностики артрита — скорость оседания эритроцитов. Это неспецифический лабораторный показатель, отражающий соотношение фракций белков плазмы. Кроме клеточных элементов, в крови содержатся белки, вода, различные биохимические субстраты. Эритроциты (красные кровяные тельца) не могут долго оставаться во взвешенном состоянии в пробирке с кровью, поэтому начинают опускаться на дно. Скорость их оседания зависит от присутствия в крови других компонентов. Если в ней много белков (диагностических маркеров воспаления), то эритроциты формируют агрегаты и быстро опускаются на дно пробирки. Выявления высоких значений СОЭ свидетельствует о протекании острого воспаления, которое может быть признаком аутоиммунной реакции. Такие параметры указывают и на развитие тяжелой формы РА, поражение внутренних органов.
Если при исследовании образцов мочи обнаружен повышенный уровень белка и лейкоцитов, необходимо устанавливать локализацию воспаления в организме. Это только косвенный признак ревматоидного артрита, требующий дальнейшей диагностики. Обязательно выявляется содержание в моче:
- глюкозы;
- кетоновых тел;
- билирубина;
- эритроцитов;
- эпителиальных клеток.
Повышенный уровень солей может указывать на нарушение обмена веществ, осложняющего течение РА.
Анализ кала при диагностировании ревматоидного артрита проводится для исключения реактивной патологии. Ее развитие провоцирует неадекватный ответ иммунной системы на проникновение в организм хламидий, сальмонелл, шигелл. Микроорганизмы легко выявляются при бактериологическом исследовании кала.
Биохимический анализ крови
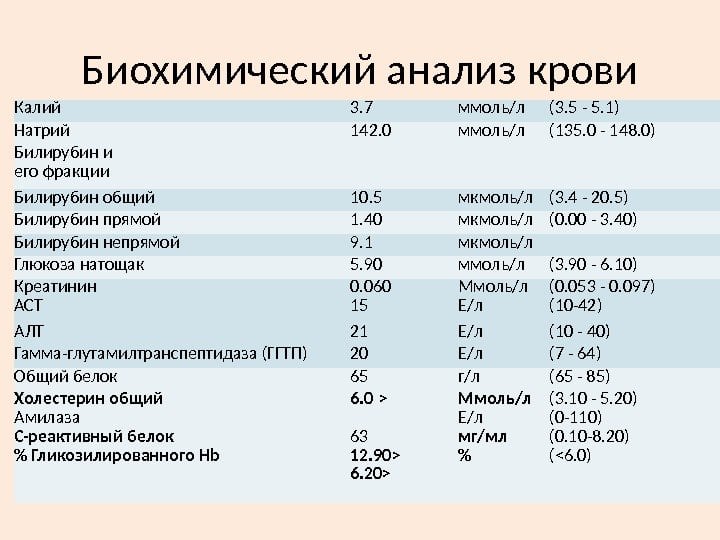
Обнаружение в крови определенных биохимических компонентов помогает установить воспалительный процесс в суставах, его интенсивность и стадию течения. Например, при рецидивах РА повышается уровень белка гаптоглобина, что служит признаком разрушения большого количества красных кровяных телец.
При проведении биохимического анализа крови на ревматоидный артрит обязательно определяется уровень фибриногена — специфического белка, находящегося в сыворотке в растворенном виде. Он служит субстратом для образования тромбов при сворачивании крови. У больных РА уровень фибриногена существенно превышает значения нормы (2-4 г/л).
Неспецифическим диагностическим маркером РА является уровень сиаловых кислот — актированных производных нейраминовой кислоты, которые входят в состав гликопротеинов. В плазме здорового человека их концентрация колеблется в пределах 2-2,33 ммоль/л. На развитие РА указывает превышение этого показателя, свидетельствующее о воспалении в суставных соединительнотканных структурах.
«Врачи скрывают правду!»
Даже «запущенные» проблемы с суставами можно вылечить дома! Просто не забывайте раз в день мазать этим…
>
При проведении биохимического анализа крови при ревматоидном артрите выявляется содержание серомукоидов (сывороточных протеинов), иммуноглобулинов, пептидов. Если их концентрация превышает значения нормы, то врачи подозревают острое, прогрессирующее течение РА.
C-реактивный белок

Так называется белок плазмы крови, относящийся к группе протеинов острой фазы, концентрация которых повышается при воспалительном процессе. С-реактивный белок вырабатывается в большом количестве во время иммунного ответа на проникновение в организм инфекционных или аллергических агентов. Обнаружение уровня этого диагностического маркера помогает дифференцировать РА от артритов невоспалительного характера. Количественное содержание С-реактивного белка необходимо для оценки активности воспаления. Этот критерий в дальнейшем позволяет отследить:
- результативность терапии;
- вероятность прогрессирования дегенеративно-дистрофических изменений в хрящевых, костных, соединительнотканных структурах.
Биохимический маркер не специфичен, так как не позволяет точно выяснить, что спровоцировало воспаление и ее локализацию. Уровень С-реактивного белка всегда увеличивается при аутоиммунных, бактериальных, вирусных патологиях. Но обнаружение этого изменения состава крови с высокой вероятностью указывает на развитие системной патологии, поражающей не только суставы, но и внутренние органы.
Ревматоидный фактор
Важный диагностический маркер РА, обнаруживаемый в крови более чем у 80% пациентов. Ревматоидный артрит развивается при атаке иммунной системы на собственные клетки организма, принимаемые ею за чужеродные белки. Для их уничтожения она продуцирует огромное количество антител — ревматоидного фактора. Эти иммуноглобулины разрушают сначала синовиальную оболочку, а при отсутствии врачебного вмешательства вскоре поражают соединительные ткани внутренних органов.
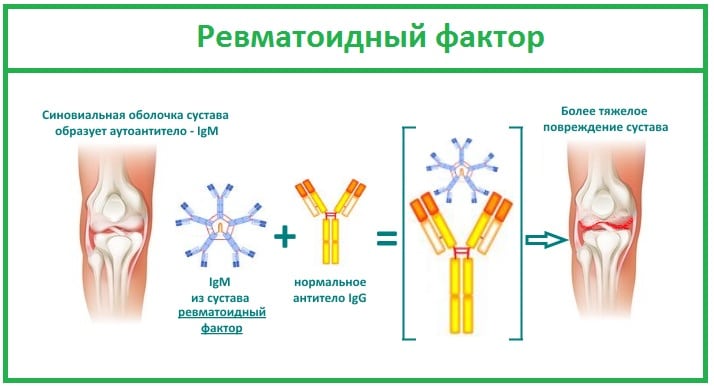
Ревматоидный фактор — один из важных диагностических критериев РА. Но является высокоспецифичным, но требует подтверждения данными, полученными при проведении инструментальных исследований. Дело в том, что высокий уровень ревматоидного фактора в крови характерен и для других заболеваний:
- системной красной волчанки;
- дерматомиозитов;
- васкулитов;
- склеродермии;
- бактериальных, вирусных, грибковых, паразитарных патологий.
Высокий уровень ревматоидного фактора на начальном этапе РА, когда суставы повреждены незначительно, является характерным признаком быстрого прогрессирования и тяжелого течения патологии. Этот критерий часто выявляется во время терапии для оценки ее эффективности.
Антицитруллиновые и антинуклеарные антитела
В процессе аутоиммунной реакции продуцируются антинуклеарные антитела, предназначенные для атаки белковых ядер собственных клеток организма. Показанием для определения количественного содержания обычно становится высокий уровень СОЭ, указывающий на развитие воспалительного процесса. Маркер неспецифичен, так как выявляется и при других патологиях:
- коллагенозе, системной красной волчанке, поражающих соединительные ткани;
- склеродермии;
- гепатите;
- реактивном артрите.
С помощью уровня антинуклеарных антител удается косвенно подтвердить развитие РА. Это особенно ценно при его серонегативной форме с отсутствием ревматоидного фактора в крови.
Самый специфичный маркер, выявляющий при проведении биохимических анализов при артрите, — наличие в крови антицитруллиновых антител, вырабатываемых иммунной системой к циклическому цитруллиновому пептиду. Химическая структура цитруллина схожа со строением аминокислоты, входящей в состав белковой молекулы. Эти белки — строительные элементы суставной капсулы, которая атакуется иммуноглобулинами при РА.
Если в крови пациента обнаруживается повышенный уровень АЦЦП, то с более чем 90% вероятностью можно предположить развитие ревматоидного артрита. Выявление антицитруллиновых антител позволяет обнаружить суставную патологию на начальной стадии и сразу приступить к лечению. Ранняя диагностика РА помогает избежать тяжелейших осложнений, в том числе необратимого поражения внутренних органов. Но, несмотря на высокую специфичность маркера, в некоторых случаях повышенный уровень АЦЦП указывает на развитие других заболеваний, не связанных с опорно-двигательным аппаратом.
Проведения этих лабораторных анализов на ревматоидный артрит бывает достаточно для подтверждения диагноза. Но в ревматологии существует 7 критериев, позволяющих с высокой точностью установить аутоиммунную патологию. Это количество вовлеченных в воспалительный процесс суставов, симметричность их поражения, выраженность симптоматики, длительность течения заболевания. При обнаружении у больного 4 из 7 критериев пациенту выставляется окончательный диагноз.
Похожие статьи
Как забыть о болях в суставах?
- Боли в суставах ограничивают Ваши движения и полноценную жизнь…
- Вас беспокоит дискомфорт, хруст и систематические боли…
- Возможно, Вы перепробовали кучу лекарств, кремов и мазей…
- Но судя по тому, что Вы читаете эти строки — не сильно они Вам помогли…
Но ортопед Валентин Дикуль утверждает, что действительно эффективное средство от боли в суставах существует! Читать далее >>>
загрузка…
Источник
