Кто такое амилаза в биохимическом анализе крови
25 февраля 2019830,8 тыс.
Амилаза крови при диагностических процедурах может дать представление о состоянии поджелудочной и слюнных желез, поскольку именно эти железы производят амилазу. Если говорить о патологиях, то анализ на амилазу достоверен при панкреатите.
Увидев в результате анализа крови термин альфа амилаза, можно задаться вопросом, как соотносятся между собой просто амилаза и альфа амилаза. В жизни медицина имеет дело с тремя типами амилаз: альфа-, бета- и гамма-.
Бета амилаза характерна для бактерий и грибов, а также имеет место у растений. Гамма амилаза работает в кислых средах при pH около 3. А вот альфа амилаза как раз “настроена” на условия, которые поддерживаются в человеческом организме. В частности, активна при pH около 7-ми. Напомним, что в крови человека pH поддерживается очень строго на уровне 7.4 с очень малым отклонением.
Что такое амилаза
Амилаза – это фермент пищеварения, отвечающий за катализирование расщепления сложных углеводов (крахмал, гликоген, а также некоторые сахариды) до простых моносахаридов, которые легко усваиваются в кишечнике.
Для человеческого организма характерна работа одного из типов амилазы. Не вдаваясь в лишние подробности биохимического процесса отметим, что мы говорим альфа амилаза, подразумевая амилазу для человека, что по большей части идентично (хотя нюансы имеются).
Функции
За выработку альфа-амилазы отвечают поджелудочная железа (этот тип амилазы является одним из компонентов пищеварительного сока) и слюнные железы (фермент выделяется в ротовую полость тремя парами желез). Амилаза активна только в ЖКТ и условиях узкого оптимума рН (7.1).
Основная функция амилазы заключается в гидролизе крахмала.
Процесс его ферментативного расщепления начинается уже в ротовой полости, под действием амилазы слюны. После достижения пищей желудка, работа слюнной амилазы прекращается, так как рН желудка равен 2-3 (в этих условия фермент неактивен).
У людей, любящих «перекусывать на ходу», плохо пережевывая пищу, амилаза слюны практически не участвует в процессе переваривания крахмала. Поэтому, его гидролиз происходит преимущественно в 12-типерстной и тощей кишках, под действием альфа-амилазы поджелудочной железы (ПЖ).
Следует учесть еще один момент – время активности. Дело в том, что альфа амилаза активна днем, поскольку приемы пищи соответствуют этому времени суток, а вот в ночное время организм отдыхает, а вместе с ним не проявляет активности и пищеварительный фермент.
Очень важно! Не пережевывая как следует пищу, “перекусывая на бегу”, позволяя себе походы ночью к холодильнику, мы тем самым выключаем альфа амилазу из процесса переваривания пищи. Это чревато как минимум развитием панкреатита.
Амилаза в крови
В крови амилаза не функционирует. Она выявляется в анализе в минимальных количествах, как результат естественного обновления клеток ПЖ и слюнных желез. Около 60-ти процентов циркулирующей в крови амилазы составляет слюнная, остальные сорок – панкреатическая амилаза.
Из организма фермент выводится преимущественно почками, с мочой. Учитывая маленький размер молекулы амилазы (в сравнении с другими ферментами), она свободно проходит через почечные клубочки. В связи с этим, она в норме может обнаруживаться в моче. Уровень фермента в моче увеличивается при повышении ее уровней в крови.
Анализ на амилазу
Альфа амилазу крови выявляют при помощи биохимического анализа. Для того, чтобы его показатели были наиболее достоверными, забор венозной крови должен осуществляться утром (натощак). Минимальное количество времени, прошедшее от последнего приема пищи – восемь часов.
За два дня до проведения исследования необходимо ограничить, а лучше прекратить употребление жирной, жареной пищи. За сутки исключается крепкий чай и кофе.
Употребление спиртных напитков приводит к выраженному повышению альфа-амилазы в крови. Если обследование проводится планово, желательно минимум за одну неделю до забора материала для анализа отказаться от приема спиртного.
Также, к повышению амилазы приводит лечение:
- нестероидными противовоспалительными средствами,
- препаратами золота,
- каптоприлом,
- фуросемидом,
- антибиотиками тетрациклинового ряда,
- введением адреналина и наркотических анальгетиков.
У женщин повышение уровня фермента может быть обусловлено приемом таблетированных эстрогенсодержащих контрацептивов.
Важно. По экстренным показаниям (острый панкреатит) анализ берется в любое время. Также ее уровень контролируется в динамике, так как показатель фермента может изменяться в течение дня (показатели будут зависеть от тяжести болезни).
Норма амилазы в крови
При проведении исследования оценивается:
- общее количество альфа-амилазы (слюнной и панкреатической);
- уровень альфа-амилазы ПЖ.
Результаты исследования записываются в Ед/л.
Норма общей альфа-амилазы:
- у малышей до двух лет составляет от пяти до 65-ти;
- с двух до семидесяти лет – от 25-ти до 125;
- у пациентов старше семидесяти лет – от 20-ти до 160-ти.
Показатели панкреатической амилазы:
- у малышей до шести месяцев норма амилазы менее 8-ми;
- с шести месяцев до года – до 23-х;
- с года до десяти лет – до 31-го;
- с 10-ти до восемнадцати лет – до 39-ти лет;
- у пациентов старше восемнадцати лет норма до 53-х.
Показатели амилазы для женщин и мужчин одинаковые.
Когда необходимо проводить анализ
Главными показаниями являются острые и хронические (в стадии обострения) панкреатиты.
Внимание. Показатель амилазы является важным диагностическим показателем при клинике «острого живота».
При различных патологиях ПЖ (панкреатит, обтурация панкреатического протока камнем, метастазом или первичной опухолью) происходит выброс панкреатической амилазы в общий кровоток. Важно понимать, что увеличения слюнной альфа-амилазы при этом не происходит. При остром поражении ПЖ, активность панкреатического фермента, может составлять до 90% от общего показателя.
При трактовке анализов необходимо учитывать, что увеличение общей активности фермента со снижением показателя панкреатической амилазы свидетельствует о том, что поражение поджелудочной железы маловероятно. В такой ситуации необходимо исключать патологию кишечника, яичников, скелетных мышц (в них также содержится альфа-амилаза, однако в минимальных количествах).
Чаще всего анализ на альфа-амилазу проводят при:
- воспалении околоушной железы (эпидемический паротит-свинка или неэпидемический, в следствие обтурации протока железы камнем и т.д.);
- поражении ПЖ (острые и хронические, в стадии обострения панкреатиты, декомпенсированный сахарный диабет (кетоацидоз));
- дифференциальной диагностики причин «острого живота»;
- вирусных инфекциях;
- муковисцидозе (кистозный фиброз ПЖ).
Амилаза повышена. Причины
Чаще всего фермент повышается при поражении ПЖ. Активность фермента при острых панкреатитах может возрастать в десять раз от номы. В ряде случаев, у пациентов амилаза в крови может возрастать лишь незначительно, либо оставаться в нормальных пределах.
Это связано с тем, что не существует прямой связи между тяжестью поражения тканей поджелудочной и ростом амилазы. Так как в результате массивной деструкции тканей органа, погибает большая часть клеток, которые вырабатывают этот фермент. Поэтому амилаза может оставаться в пределах нормы.
При хронических панкреатитах амилаза вначале повышается, а затем, когда погибает значительное количество клеток железы, уровень фермента снижается.
Очень важно. Если амилаза снижается на фоне прогрессирования клинической симптоматики, это служит плохим прогностическим признаком, так как говорит о тяжелой деструкции ткани поджелудочной железы.
У пациентов с декомпенсированным сахарного диабета амилаза повышается в следствие:
- кетоацидоза (из-за высоких показателей сахара);
- поражения (ПЖ).
Также причинами увеличения амилазы в анализе могут быть травмы, кисты и злокачественные опухоли ПЖ, метастатическое поражение органа, обтурация панкреатического протока камнем (метастазом или первичной опухолью).
Важно помнить, что амилаза повышена может быть также при:
- паротите;
- остром аппендиците;
- кишечной непроходимости;
- ишемии кишечника;
- перитоните;
- злокачественных опухолях яичников;
- ОПН и ХПН (острая и хроническая почечная недостаточность);
- остром холецистите;
- внематочной беременности;
- ЧМТ (черепно-мозговая травма);
- прободении язвы желудка;
- алкогольной интоксикации;
- разрыве аневризмы аорты.
Редкой причиной увеличения альфа-амилазы считается макроамилаземия. Это заболевание, сопровождающееся соединением амилазы с крупными плазменными белками в макроамилазу, которая не проходит через клубочки почек (из-за крупного размера соединения) и как следствие, накапливается в крови.
Точные причины заболевания неизвестны, однако наибольшую роль в патогенезе макроамилаземии играют хронические панкреатиты, длительное лечение глюкокортикостероидами и прием салицилатов.
Когда амилаза понижена
Низкий уровень фермента встречается намного реже, чем повышенный. Такие изменения в анализе характерны для недостаточности ПЖ, муковисцидоза, тяжелых поражений печени (печеночной недостаточности), панкреоэктомии (удаления ПЖ).
Увеличенный уровень холестерина в крови может приводить к занижению показателей панкреатической амилазы.
У детей первого года жизни уровень фермента намного ниже, чем у взрослых. Это связано с тем, что пища, которую они получают, лишена достаточного количества сложных углеводов.
Чем опасно изменение уровня фермента
Само по себе состояние, когда амилаза повышена не имеет клинических последствий для организма, однако, оно является важным маркером поражения ПЖ. При обнаружении повышения показателя фермента, как правило проводят контроль анализа в течение суток, что позволяет оценить динамику патологического процесса.
Понижение уровня фермента на фоне ухудшения самочувствия больного, свидетельствует о тяжелой деструкции ткани поджелудочной железы. Следует обратить пристальное внимание к ситуации. Просто необходимо надоедать врачу до тех пор, пока не будут понятны причины.
Очень важно. Слюнные железы в меньшей степени, а вот поджелудочная железа крайне чувствительный орган, легко подвергающийся “поломке” с очень тяжелыми последствиями вплоть до летального исхода. Важность ПЖ подчеркивается снабжением ее кровью по двум независимым артериям.
Источник
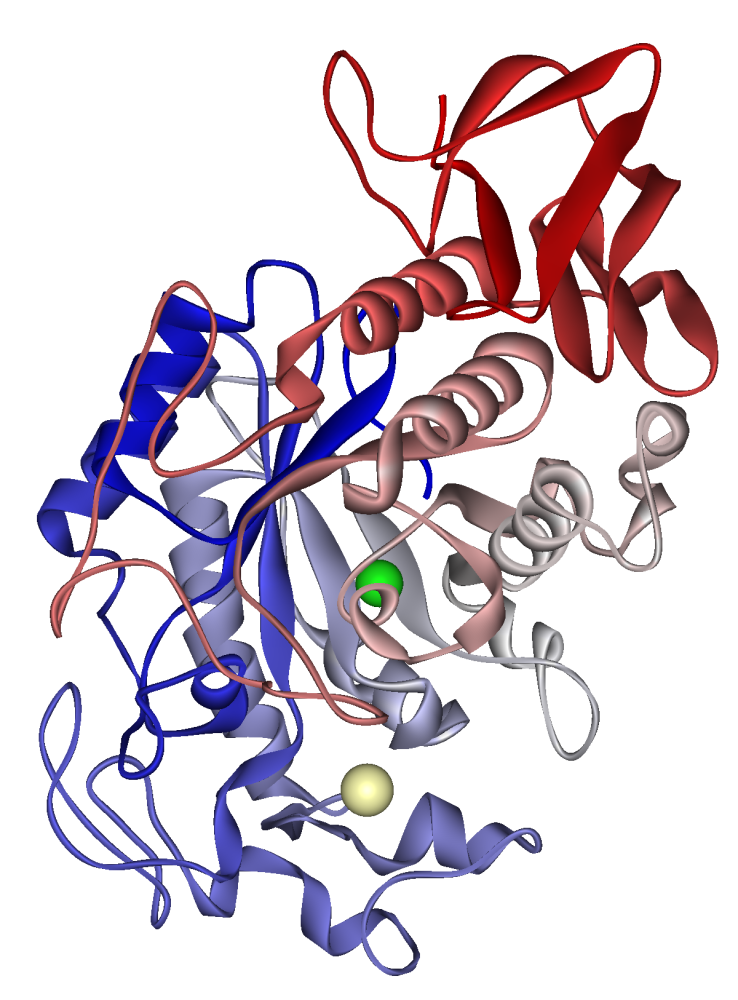
Структура амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.
Амила́за (др.-греч. ἄμυλον — крахмал) — фермент, гликозил-гидролаза, расщепляющий крахмал до олигосахаридов, относится к ферментам пищеварения. В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайен описал в 1833 году диастазу[en]* — фермент (на самом деле, смесь ферментов), расщепляющий крахмал до мальтозы. Согласно другим данным, амилазу в 1814 году открыл академик петербургской Академии наук К. С. Кирхгоф. Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов (например, из риса или картофеля), но без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения. Расщепляет α-1,4-гликозидную связь.
Классификация[править | править код]
По субстратной специфичности амилазы классифицируют на альфа-, бета- и гамма-амилазу.
α-Амилаза[править | править код]
α-Амилаза (1,4-α-d-глюкан-глюканогидролаза, гликогеназа; шифр КФ — 3.2.1.1) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы[1]. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна в нейтральной среде (pH = 6,7—7,0). Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus).
β-Амилаза[править | править код]
β-Амилаза (1,4-α-d-глюкан-мальтогидролаза; шифр КФ — 3.2.1.2) присутствует у бактерий, грибов и растений, но отсутствует у животных. Она отщепляет вторую с конца α-1,4-гликозидную связь, образуя, таким образом, дисахарид мальтозу. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара́, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственно прорастании семени.
β-Амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза[править | править код]
γ-Амилаза (1,4-α-d-гликан-глюкогидролаза, глюкан-1,4-α-глюкозидаза, амилоглюкозидаза, экзо-1,4-α-глюкозадаза, глюкоамилаза, лизосомальная α-глюкозидаза; шифр КФ — 3.2.1.3) отщепляет последнюю α-1,4-гликозидную связь, приводя к образованию глюкозы. Кроме этого, γ-амилаза способна гидролизовать α-1,6-гликозидную связь. В отличие от других амилаз, γ-амилаза наиболее активна в кислых условиях (при pH = 3).
Применение[править | править код]
Некоторые виды дрожжей способны разлагать крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате этанол, углекислый газ (CO2) и другие метаболиты, которые придают хлебу специфический вкус и «поднимают» тесто. Но пекарские дрожжи (Saccharomyces cerevisiae) этого не могут, поэтому в современных хлебопекарных технологиях амилаза используется как одно из важных составляющих специальной добавки. Добавление амилазы в тесто позволяет использовать для жизнедеятельности дрожжей часть крахмала муки, ускоряя тем самым процесс брожения, и одновременно позволяет изготовителю хлеба сэкономить, уменьшив количество используемого сахара.[источник не указан 866 дней]
Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
В пищевой промышленности амилаза зарегистрирована в качестве пищевой добавки E1100 как улучшитель муки и хлеба.
Примечания[править | править код]
Ссылки[править | править код]
- Амилаза (Amylase) // Медицинские термины (рус.). — 2000.
Источник
