Иммунохимический анализ крови на миелому
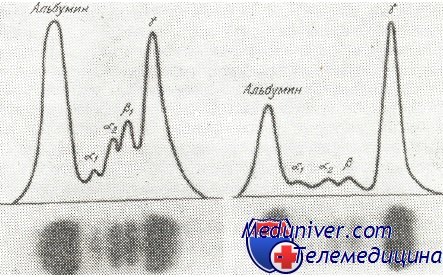
Лабораторная диагностика множественной миеломы — анализыАнализ периферической крови показывает, у большинства больных с множественной миеломой, наличие анемии. Эта анемия, обычно умеренная, гипохромного типа может быть иногда сильно выраженной (менее 1 миллиона гематий/мм3). На мазке наблюдаются аспекты анизоцитоза и пойкилоцитоза. Гематии проявляют часто тенденцию располагаться в виде «монетных столбиков»,—явление, связанное с наличием миеломатозных протеинов в сыворотке и с их скоплением на поверхности гематий. Количество Гб также понижено. Число лейкоцитов, вариабильное, нормальное или повышенное. В развитых стадиях болезни можно наблюдать лейкопении, отягощаемые и применяемыми цитостатическими лечениями. Лейкоцитарная формула, обычно нехарактерная, может показывать иногда повышенное число плазмоцитарных элементов, подобных клеткам в костном мозге. Число тромбоцитов нормальное или умеренно пониженное. Исследование костного мозга при множественной миеломе имеет важнейшее значение для постановки диагноза. Костная пункция производится обычно в грудную кость или в подвздошный гребень, но ее можно производить и в другие затронутые кости: позвонки, пяточную кость, ключицу. Иногда проникание в кость происходит очень легко, костная ткань давая ощущение особой хрупкости. Для миеломы характерен численный рост плазмоцитарной серии, которая может составлять 90% клеточного населения костного мозга. Вообще, при 20% плазмоцитарных элементов ставится вопрос о существовании миеломы. Аномалийные плазмоцитарные элементы или так называемые «миеломатозные клетки», это клетки диаметром в 15—30(л, круглые или овальные. Ядро, диаметром в 5—7у., круглое, расположенное эксцентрично, содержит 1—2 нуклеоли. Нуклеарный хроматин менее комковатый и уже не представляет тот регулярный порядок, который наблюдается в нормальном плазмоците. Цитоплазма этих клеток интенсивно базофильная, становится яркосиней при окрашивании May-Grunwald-Giemsa (цветная вклейка III). В цитоплазме миеломатозных клеток можно встретить гиалиновые шарики (тела Russel), многочисленные вакуоли, придающие клетке вид ежевики (клетки Mott), или хрустальные азурофильные включения иногда подобные телам Auer при миелобластической лейкемии (протеиновые кристаллы) (цветная вклейка III). Вариабильное число клеток может иметь 3 или более ядер. Другие имеют сильно выраженные черты незрелости: они более крупных размеров (20—35u) с болыпдм, круглым ядром, с очень тонким хроматином, а цитоплазма интенсивно базофильная. Встречаются также и несколько зрелых плазмоцитарных клеток, с ядром в виде «колесной спицы » и ясной перинуклеарной зоной. Иногда плазмоциты могут иметь ацидофильную цитоплазму, так называемые «пламенистые клетки » (flaming cells) (цветная вклейка III). С цитохимической точки зрения, цитоплазма миеломатозных клеток является пероксидазо-отрицательной и окрашивается метахроматически с метиловой зеленью. Гиалиновые шарики (тела Russel) обычно PAS-положительные. Миеломатозные клетки преставляют множество нуклеоцитоплазматических асинхронизмов созревания. Согласно Bernier и Graham, степень этих асинхронизмов пропорциональна клиническому распространению заболевания.
Исследования при помощи электронного микроскопа показали наличие определенных аномалий на уровне клеточных органитов, аномалии тем более явные, чем менее дифференцирована миеломатозная клетка. Митохондрии численно увеличены и имеют патологические аспекты: удлиненные, кольцевидные, иногда с чертами миелиновой дегенерации; аппарат Гольджи везикулярнио трансформирован, центриоли имеют гигантский удлиненный вид, а число рибозомов может возрастать (Bessis). Наиболее интересный аспект представляет эргастоплазмический аппарат. В большинстве случаев он расширен и имеет везикулярный вид. Содержимое эргастоплазмических везикул состоит из протеина и имеет твердую консистенцию, принимая аспект тел Russel, либо в растворимой форме, flaming cells или тезауроцотив (Paraskevas и сотр.), либо в кристаллизованной форме. Протеиновые кристаллы бирефрингентные с периодичностью около 110 A (Bessis). В других случаях эргатоплазмический аппарат менее развит и представлен несколькими пластинками, а редко бывает плохо развитым, подобным лимфоидной клетке. На уровне ядра появляются аномалийные, гипертрофированные нуклеоли, а также и множество интрануклеарных вакуолей (Smetena и сотр.). Некоторые авторы описали наличие в ядре вирусных телец, в 15% случаев (Sorensen), тельца, которые Bessis нашел лишь в одном из 12 изученных им случаев. Иммунохимические и иммунофлюоресцентные исследования, с разными специфическими антисыворотками (IgG, IgA, IgM, IgD IgE, ламбда, каппа) показали наличие Ig в цитоплазме миеломатозных клеток. Они локализированы в особенности на уровне эргастоплазмического аппарата и рибозомов. Делались попытки установить связь между морфологическим аспектом клеток и типом секретированного Ig. Полученные до настоящего времени результаты неубедительны. Paraskevas и сотр. утверждают, что пламенистые клетки секретируют IgA. Цитогенетическое исследование множественной миеломы показало существование разных форм анейплоидии, но которые наблюдаются не во всех случаях. Кроме этого кыло описано и присутствие различных хромозомов маркеров. Вследствие внедрения метода бандирования, Liang и Rowley нашли хромозом 14р+ у 3 больных с множественной миеломой и 1 больного с плазмоцитарной лейкемией, из 22 изученных больных. Этот хромозом 14q+ был найден и при других лимфомах типа Б, а также, изредка, и при лимфомах non-Б. Следует отметить, что Croce и сотрудники установили, что структуральные гены для тяжелых цепей Ig локализированы у человека на хромозоме 14. Исследование протеинового обмена при множественной миеломе. Расстройства протеинового метаболизма составляют характерный аспект множественной миеломы. Злокачественно модифицированные плазмоциты сохраняют и усиливают способность синтетизировать цельные Ig или только определенные составные части глобулиновой молекулы. Изменения протеинового метаболизма проявляются в трех формах: В сыворотке большинства больных, общее количество протеинов повышено, достигая 23 г/100 мл. Среднее количество сывороточных протеинов у больных с миеломой равняется 9 г/100 мл. Этот рост происходит за счет глобулинов, точнее Ig. При электрофорезе на бумаге или в агаре наблюдается появление узкой и высокой полосы, с заметным сокращением остальных дуг. Это является изображением количественного роста гомогенного населения глобулинов. Пик находится обычно в зоне миграции у-глобулинов или b-глобулинов. Аномалийный протеин, находящийся в сыворотке больных с миеломой, получил название парапротеина, миеломатозного глобулина (М-глобулин) или компонента М. В рамках множественной миеломы может происходить: В настоящее время миеломы делятся по типу секретируемого Ig: миеломы IgG наиболее частые, встречающиеся в 60% случаев; миеломы IgA, в 20—25% случаев; IgD, в 2,1% случаев; и ограниченное число миелом IgE. Среди случаев множественной миеломы, 20% — с цепями L (миеломы Бенс-Джонса), причем некоторые без патологического протеина в сыворотке, так как он элиминируется через мочу. Очень малый процент заболеваний (1%) не представляет изменений протеинового метаболизма (несекретирующие миеломы). В рамках миелом IgG, наблюдается следующее распределение на субклассы (Schur): yG1 60—82%; yG2 10—18%; yG3 6—15%; yG4 1—8%. Сравнивая эти цифры с относительными концентрациями в нормальной сыворотке (гл. 7) можно утверждать, что моноклональные Ig типа yGl и yG3 встречаются чаще по сравнению с yG2. Характерной чертой миеломатозного Ig является его гомогенность: узкая зона электрофоретической миграции, индивидуальная антигенная специфичность и цепь L только одного типа (ламбда или каппа). При миеломах IgG и IgA преобладают случаи с цепями каппа (2/3 случаев) (Hobbs и Corbet); при миеломах IgD, цепи ламбда преобладают в 90% случаев, в то время как при миеломах Бенс-Джонса, цепи ламбда присутствуют приблизительно в 45% случаев (Jancelewicz и сотр.). До сих пор не удалось выявить физико-химические или иммунохимические различия между миеломатозными протеинами и соответствующими им нормальными Ig. Было доказано, что миеломатозные Ig обладают способностью связываться с другими веществами, следовательно действовать как антитела. Такая антителовая деятельность отмечалась по отношению к бактериальным соединениям (стрептолизин 0 или спрептококковая гиалу-ронидаза), к гематиям, к некоторым сывороточным протеинам, а также и к гаптенам (динитрофенол, 5-ацетоурацил, пуриновые и пиримидиновые нуклеотиды) (Osterland и сотр.). Способность миеломатозного протеина связываться с гематиями или сывороточными протеинами порождает определенные симптомы, как например агглютинация гематий в виде монетных столбиков, явления повышенной кровоточивости и пр. Значительная диспротеинемия в крови больных с множественной миеломой оказывает влияние на все пробы коллоидальной лабильности.
Реакции на формол-гелифицирование, сульфат кадмия, Вельтмана — положительные. Реакция Sia (помутнение сыворотки в дистилированной воде) — слабо или умеренно положительная. Тесты на коагуляцию модифицированы у некоторых больных. Патологические протеины в сыворотке могут интерферировать с различными фазами коагуляции, как например в трансформация фибриногена в фибрин, во взаимодействии с факторами II, V и VII. Функции тромбоцитов могут быть также модифицированными. Анализ мочи показывает наличие протеина Бенс-Джонса в 40—50% случаев, когда он детерминируется путем нагревания и в 61% случаев, когда он выявляется путем иммуноэлектрофореза. Он представлен выведением легких цепей. Протеин Бенс-Джонса преципитирует в моче нагретой до 50—60°, создавая беловатое облако, которое перерастворяется при кипячении. В случае ассоциированной альбуминурии, перерастворение является неполным и иногда оказывается неполным и без альбуминурии. В такой ситуации мочу можно сделать прозрачной путем добавления нескольких капель 5%-й уксусной кислоты. Физикохимическое исследование альбумина Бенс-Джонса показало, что он состоит из легких цепей, димеризованных дисульфидными связями. Постоянно легкая цепь в моче идентична с легкой цепью сывороточного миеломатозного протеина. В мочевом осадке могут появляться цилиндры, гематии, а в случаях почечного калкулеза появляются кристаллы фосфатов, уратов, а также гематии и лейкоциты. Гиперкальцемия встречается часто при множественной мизломе (20—53% случаев), достигая 12—16 мг/100 мл сыворотки. Этот рост связан в первую очередь с процессами костной деструкции, но и с гиперпаратиреоидизмом, как вторичное явление почечной недостаточности. Гиперкальцемия при множественной миеломе не сопровождается ростом фосфора в крови, а щелочные сывороточные фосфатазы находятся в нормальных пределах, что представляет ценные данные для дифференциальной диагностики по отношению к первичному гиперпаратиреоидизму. Сывороточная мочевая кислота бывает часто повышена, а в случаях, осложняющихся почечной недостаточностью, наблюдается рост креатинина и непротеинового азота. Патологоанатомическое исследование при множественной миеломе. Наиболее явные изменения встречаются на уровне скелета, особенно в черепных костях, позвонках, ключицах, ребрах, грудной кости, лопатке, тазовых костях. Длинные кости затронуты в меньшей мере. На срезе, кость оказывается мягкой, а нормальная ткань заменяется красноватой или серо-красноватой туморальной тканью. Иногда опухоль переходит за периост, инфильтрируя смежные участки.
Микроскопически, туморальная ткань состоит из пролиферации злокачественных плазмоцитоидных клеток, описанных при исследовании костного мозга. На срезе остеокласты и остеобласты немодифицированы. В редких случаях внекостных миелом можно обнаруживать плазмоцитарные опухоли в различных органах, причем характерные особенности пролиферированных клеток подобны тем, которые наблюдаются при костных опухолях. При множественной миеломе почка бывает часто затронута. Наиболее важные поражения встречаются на уровне канальцев. Дистальные канальцы расширены, с уплощенным эпителием и просветами заполненными эозинофильными и полихроматофильными цилиндрами. На периферии этих цилиндров встречаются многоядерные синцитин эпителиальных клеток. Цилиндры состоят из цельного миеломатозного Ig или из цепей L (протеин Бенс-Джонса). На электронном микроскопе, эти цилиндры имеют фибрилярную, амилоидную структуру (Abrahams и сотр.). Не удалось установить несомненную связь между наличием амилоида и протеинурией Бенс-Джонса. Несмотря на это, Glenner и сотр. показали in vitro образование амилоидных волокон путем протеолитической дигестии человеческого протеина Бенс-Джонса. Возможно, что подобный процесс происходит и на уровне почечных канальцев (Zlotnick). В тубулярных эпителиальных клетках часто встречаются отложения кальция. Также на уровне почечных канальцев было отмечено наличие кристаллов, находящихся как в просвете, так и в эпителии. Их химическая структура не была установлена. Почечные гломерулы бывают реже затронутыми при множественной миеломе. Отмечается утолщение базальной мембраны и мезангиомы, которое выступает с особенной ясностью на электронном микроскопе. Встречается также и гипертрофия эндотелиальных и эпителиальных клеток. В развитых фазах болезни появляются гиалиноз и склероз. Иногда в гломерулах можно найти отложения амилоида, что приводит к его гомогенизации. Почечная интерстициальная ткань представляет инфильтрационные поражения, либо благодаря миеломатозным клеткам, либо благодаря клеткам хронического воспаления. — Также рекомендуем «Клинические формы множественной миеломы — стадии» Оглавление темы «Миеломная болезнь»:
|
Источник
Метод определения
Электрофорез и иммунофиксация пентавалентной антисывороткой с оценкой содержания М-компонента с помощью денситометрии.
Исследуемый материал
Сыворотка крови
Выявление и типирование моноклональных парапротеинов.
Иммуноглобулины – белки, обладающие активностью антител (способностью специфично связывать определенные антигены).
В отличие от большинства белков сыворотки крови, которые вырабатываются в печени, иммуноглобулины продуцируются плазматическими клетками – потомками стволовых клеток предшественников В-лимфоцитов в костном мозге. По структурным и функциональным различиям выделяют 5 классов иммуноглобулинов – IgG, IgA, IgM, IgD, IgE и ряд субклассов. Поликлональное увеличение количества иммуноглобулинов – нормальный ответ на инфекции.
Моноклональные гамммапатии – состояния, когда клоном плазматических клеток или В-лимфоцитов (популяцией клеток, берущих начало от одной В-клетки предшественника) продуцируется аномальное количество иммуноглобулина. Такие состояния могут быть доброкачественными или являться проявлением болезни. Моноклональные гаммапатии выявляют по появлению аномальной полосы белка при электрофорезе сыворотки или мочи.
Молекулы иммуноглобулинов состоят из одной или более структурных единиц, построенных по единому принципу — из двух идентичных тяжелых цепей и двух идентичных легких пептидных цепей – каппа или лямбда. Разновидности тяжелых цепей являются основой деления иммуноглобулинов на классы. Цепи иммуноглобулинов имеют константные и вариабельные участки, последние связаны с антигенной специфичностью.
Иммуноглобулин, продуцирующийся одним клоном клеток, имеет идентичную структуру — представляет один класс, подкласс, характеризуется идентичным составом тяжелых и легких цепей. Поэтому если в сыворотке присутствует аномально большое количество моноклонального иммуноглобулина, в процессе электрофоретического разделения белков сыворотки крови он мигрирует в виде компактной полосы, которая выделяется на фоне стандартной картины распределения белковых фракций сыворотки. При описании результатов электрофореза белков сыворотки его называют также парапротеином, М-пиком, М-компонентом, М-белком или М-градиентом. По структуре такой моноклональный иммуноглобулин может быть полимером, мономером или фрагментом молекулы иммуноглобулина (в случае фрагментов чаще это легкие цепи, реже – тяжелые). Легкие цепи способны проходить через почечный фильтр, и могут быть обнаружены при электрофорезе мочи.
Выявление моноклональных парапротеинов основано на применении электрофореза белков. Иногда фибриноген и СРБ, которые мигрируют в бета или гамма-фракции, могут быть ошибочно расценены как парапротеины. Иммуноглобулиновую природу выявленного моноклонального компонента подтверждают с помощью иммунофиксации разделенных белков специфической поливалентной преципитирующей антисывороткой, направленной против иммуноглобулинов (тест № 4050). При подтверждении присутствия моноклонального иммуноглобулина проводится денситометрия и определяется его количественное содержание. Для полноценной идентификации (типирования) моноклонального компонента требуется развернутое исследование с помощью электрофореза и иммунофиксации с развернутой панелью антисывороток против IgG, IgA, IgM, каппа и лямбда цепей (тест № 4051). В диагностике и прогнозе учитывают класс выявленного парапротеина, его концентрацию в момент установления диагноза, скорость повышения его концентрации в динамике. Наличие парапротеина является маркером ряда гематоонкологических заболеваний.
При обследовании пациентов, применяющих лекарственные препараты на основе моноклональных антител (могут использоваться в качестве противоопухолевой терапии, иммунодепрессантов и др.), следует учитывать, что на пиковых концентрациях после введения такие препараты иногда могут быть причиной выявления при электрофорезе малых аномальных полос белка иммуноглобулиновой природы.
Множественная миелома — классическое гематологическое заболевание, обусловленное злокачественной пролиферацией плазмацитов, секретирующих моноклональный иммуноглобулин (парапротеин) или его фрагменты. Плазматические клетки чаще пролиферируют диффузно в костном мозге, заболевание приводит к остеолитическим поражениям костей, редукции других клеток костного мозга, что ведет к анемии, тромбоцитопении, лейкопении, ингибирует развитие нормальных клонов плазматических клеток. Пациенты могут обращаться с локальными симптомами патологии костей (боли, переломы) или неспецифичными симптомами (потеря веса, анемия, кровотечения, повторные инфекции или почечная недостаточность). У большинства больных на момент установления диагноза концентрация парапротеина превышает 25 г/л. При миеломе парапротеин в сыворотке крови чаще всего представлен IgG (60%), реже IgA (20%) и около 20% случаев приходятся на миелому Бенс-Джонса, связанную с продукцией свободных легких цепей каппа или лямбда (20%), которые могут быть обнаружены в моче. Иногда при миеломе может отмечаться биклональный парапротеин, представленный иммуноглобулинами разных классов или одного класса, но содержащий легкие цепи разных классов. Редко отмечается IgD и IgE миелома. Определение концентрации парапротеина используют для контроля эффективности лечения миеломы, такой мониторинг при миеломе на фоне терапии должен осуществляться каждые 3 месяца. Если содержание парапротеина снизилось ниже детектируемого, повторное измерение целесообразно проводить через 6 или 12 месяцев.
Макроглобулинемия Вальденстрема представляет собой лимфому с гиперпродукцией моноклонального IgM. Лимфоплазмацитарные опухолевые клетки с характерным иммунофенотипом диффузно распределены в лимфатических узлах, селезенке и костном мозге. Высокая концентрация моноклонального IgM часто превышает 30 г/л и приводит к увеличению вязкости крови и ряду клинических проявлений, включающих спутанность сознания, слепоту, склонность к кровоточивости, сердечную недостаточность и гипертензию. При макроглобулинемии часто отмечается парапротеинемическая полинейропатия, холодовая гемолитическая анемия и криоглобулины. При других разновидностях лимфом и хроническом лимфолейкозе парапротеины класса IgM отмечается у 20% больных, однако концентрация парапротеина обычно ниже, чем 30 г/л.
Болезнь тяжелых цепей (болезнь Франклина) сопровождается синтезом только тяжелой цепи IgG-гамма, без сопутствующей легкой цепи. Это крайне редкое заболевание проявляется отеком мягкого неба и лимфоидной инфильтрацией. Также редко отмечается болезнь тяжелых цепей альфа, при которой возникает хроническая диарея, нарушение всасывания, обусловленные лимфоидной инфильтрацией стенки кишки.
Моноклональный парапротеин может быть обнаружен при ряде неопухолевых заболеваний, в частности, при эссенциальной криоглобулинемии (чаще IgM), парапротеинемической хронической полинейропатии, холодовой гемолитической анемии, АL-амилоидозе почек (свободные цепи лямбда), и внутренних органов, болезни отложения легких цепей. Парапротеин в сыворотке крови отмечается также при болезни Кастелмана (IgM/лямбда), POEMS-синдроме (полинейропатия с органной мегалией) и микседематозном лишае (IgG/каппа).
При скрининговых обследованиях частота выявления парапротеинемии резко увеличивается в популяции после достижения 50 лет и достигает 4–10% у лиц старше 65 лет. Однако большинство впервые выявленных парапротеинемий в общей популяции представляют собой бессимптомные моноклональные гаммапатии невыясненного значения (МГНЗ). Концентрация парапротеина при МГНЗ существенно ниже 30 г/л и обычно не превышает 10–15 г/л. Кроме того, при МГНЗ парапротеин выявляется на фоне поликлональных иммуноглобулинов, т. е. угнетения нормального синтеза других иммуноглобулинов не происходит. Термин «МГНЗ» указывает на случаи парапротеинемии без других признаков онкогематологического заболевания, которые требуют ежегодного мониторинга, чтобы не пропустить момента озлакачествления процесса. При выявлении парапротеинов у обследованных моложе 50 лет необходимы еще более частые повторные обследования, поскольку у них отмечается высокий риск развития множественной миеломы. Если концентрация М-белка составляет более 15 г/л, вне зависимости от возраста рекомендуется проводить расширенное обследование, включающее электрофорез 24-часового образца мочи и иммунофиксацию каждые 3–6 месяцев, поскольку риск злокачественной трансформации очень высок. Выделяют доброкачественную парапротеинемияю, которая характеризуется сохранением парапротеина без прогрессирования в множественную миелому или другое заболевание в течение 5 лет наблюдения. При транзиторной парапротеинемии концентрация парапротеина обычно ниже 3 г/л.
Литература
1. Андреева Н.Е, Балакирева Т.В. Парапротеинемические гемобластозы // Руководство по гематологии / под ред. А. И. Воробьева. 3-е изд., М., 2003.Т. 2, с. 151-184.
2. Berenson J.R Monoclonal gammopathy of undetermined significance: a consensus statement. Br.J.Haematol., 2010, 150(1): 28-38.
Источник