Диагностическая ценность анализа ферментов плазмы крови
Энзимодиагностика. Происхождение ферментов плазмы крови.
Ферменты, плазмы крови, делятся на две группы:
1 — выполняющие специализированные функции в крови. К ним относятся:
а) ферменты системы свертывания крови,
б) ферменты, функционирующие в системе комплемента или
в) участвующие в растворении внутрисосудистых сгустков крови.
2 — ферменты, в норме выполняющими определенные функции внутри клеток (амилаза, лактатдегидрогеназа, глутамилтранспептидаза и др.) или являющихся секреторными веществами (ферменты желудочно-кишечного тракта) и не выполняющими метаболических функций в плазме. Они освобождаются из клеток крови и других тканей в результате естественного лизиса последних или при некоторых патологических состояниях.
Энзимодиагностика — определение активности ферментов в биологических жидкостях (плазме крови, моче, секретах пищеварительного тракта) для постановки диагноза заболевания. Для диагностики в клинике исследуют ферменты второй группы. В норме их активность в плазме незначительна, но увеличивается при повреждении ткани — источника ферментов, или в) при избыточной клеточной пролиферации (в период активного роста костей, особенно у детей и подростков, уровень щелочной фосфатазы повышен, увеличивается активность ряда ферментов и при онкопролиферативных процессах).
Определение ферментов в плазме крови с целью диагностики заболеваний
Ферменты плазмы крови, используемые для диагностики болезней, часто продуцируются несколькими органами или тканями, что ограничивает их диагностическую специфичность. Для повышения специфичности энзимологических исследований определяют изоферменты, которые, как правило, органоспецифичны. Полученные результаты интерпретируют в свете клинической картины.
Основные ферменты, определяемые в плазме при диагностике болезней.
Аспартатаминотрансфераза -клинически значимое увеличение активности наблюдаются при заболеваниях сердца (инфаркт миокарда), скелетных мышц (травмы, миопатии).
Аланинаминотрансфераза — патологическое увеличение активности — при острых гепатитах, циррозах печени.
гамма-Глутамилтрансфераза — наибольшее диагностическое значение изменения активности — в диагностике гепатобиллиарного тракта; активность фермента повышается у пациентов, злоупотребляющих алкоголем, особенно при алкогольных заболеваниях печени; чувствительный показатель холестаза.
альфа-Амилаза -клиническое значение определения активности амилазы в сыворотке крови состоит в том, что присутствие этого фермента является маркером:
— почечной недостаточности (при более чем 5-кратном превышении активности)
— острого панкреатита (при 10-кратном преышении уровня уровня сывороточной амилазы).
Обнаружение в крови только панкреатической альфа-амилазы служит чувствительным и специфичным тестом для диагностики панкреатита.
Креатинкиназа — исследование активности проводят при заболеваниях мышц, когда основным изоферментом в сыворотке крови является ММ (мышечный), и при инфаркте миокарда, когда доминирует изофермент MB (гибридный).
Кислая фосфатаза, основной ее источник — предстательная железа, хотя значительные количества найдены в эритроцитах, печени, селезенке, тромбоцитах, диагностические измерения активности используются для мониторинга метастатической карциномы простаты (увеличивается у 80% пациентов с этим заболеванием);
ткань — источник фермента идентифицируется с помощью ингибиторов фермента (тартрат ингибирует простатический изофермент, а формальдегид ингибирует изоферменты из других тканей).
Щелочная фосфатаза, катализирует гидролиз эфиров фосфорной кислоты, патологическое увеличение активности — при заболевания гепатобилиарного дерева (холестаз, обтаруционная желтуха, цирроз, гепатиты) и костей (гиперпара-тиреоидизм, остеомаляция и др.); активность фермента определяют у недоношенных детей с цель ранней диагностики рахита;
ткань — источник фермента идентифицируется определением изоферментов щелочной фосфатазы (печеночный, костный, плацентарный, зародышевый кишечный, текстикулярный).
Лактатдегидрогеназа -катализирующая превращение пирувата в лактат, присутствует в большинстве тканей, поэтому измерение ее общей активности низкоспецифично. Диагностическую ценность представляет определение ее изоферментов.
ЛДГ1-инфаркт миокарда, ЛДГ2-острый лимфобластный лейкоз, ЛДГ3-доброкачественные опухоли женских половых органов, ЛДГ4-поражения печени, ЛДГ5-острая фаза ревматизма, кардиосклероз, поражение почек.
Определение изоформы лактатдегидрогеназы — ЛДГ1, позволяет достоверно диагностировать инфаркт миокарда. Диагностически значимым является двукратное превышение уровня этого изофермента по сравнению с нормой.
Date: 2016-05-24; view: 3079; Нарушение авторских прав
Источник
Изменения в специфических ферментативных процессах могут быть причиной или следствием различных патологических состояний. Большинство ферментативных процессов локализованы внутри клеток, но определение активности ферментов внеклеточной среды (сыворотка, плазма, слюна, моча) имеет диагностическое значение и носит название энзимодиагностика.
Для правильной трактовки результатов врачу необходимо знать основы энзимодиагностики, иметь информацию о тканевой локализации фермента, его активности в различных компартментах клетки, влиянии на активность фермента принимаемых пациентом лекарств, устойчивости фермента при хранении, наличия изоферментых форм и т.п.
Причины изменения активности ферментов в крови
Степень изменения активности ферментов клеточного метаболизма в сыворотке крови зависит от массы пораженного органа, распределения ферментов между тканями, локализации ферментов во внутриклеточных органеллах. При воспалительных процессах из клетки в первую очередь выходят цитоплазматические ферменты, при прогрессировании заболевания наблюдается некроз клеток и происходит разрушение органелл. В плазме обнаруживаются ферменты митохондрий и лизосом. Например, аланинаминотрансфераза (АЛТ, АлАТ) локализована в цитоплазме, а аспартатаминотрансфераза (АСТ, АсАТ) и в цитоплазме, и в митохондриях, глутаматдегидрогеназа – митохондриальный фермент.
Повышение активности в сыворотке крови может быть результатом ускорения процессов:
- синтеза – щелочная фосфатаза при рахите, гепатите,
- некроза клеток – АлАТ, АсАТ, ЛДГ, КК при инфаркте миокарда, кислая фосфатаза при аденоме простаты, липаза, амилаза при панкреатитах,
- понижения выведения – щелочная фосфатаза при желчнокаменной болезни,
- повышения проницаемости клеточных мембран – АлАТ, АсАТ, ЛДГ при гепатите.
Снижение активности вызывается:
- уменьшением числа клеток, секретирующих фермент (холинэстераза при циррозе печени),
- недостаточностью синтеза,
- увеличением выведения фермента,
- торможением активности в результате действия протеиназ.
В ряде случаев определенное диагностическое значение имеет установление взаимоотношений между изменением активности отдельных ферментов и получение своеобразных ферментных спектров крови. При этом удается установить достоверные ферментные симптомы отдельных заболеваний.
Например,
- острые гепатиты характеризуются резким увеличением активности аланин- и аспартатаминотрансфераз и альдолазы,
- инфаркт миокарда сопровождается увеличением активности лактатдегидрогеназы, креатинкиназы, аспартатаминотрансферазы,
- при механических желтухах характерным является нарастание содержания щелочной фосфатазы без большого увеличения активности аминотрансфераз и альдолазы.
Ферменты сыворотки крови
- Ферменты, секретируемые в плазму, и выполняющие в ней специфические функции – истинноплазменные ферменты. В плазме их активность много больше, чем в органах (церулоплазмин, псевдохолинэстераза, липопротеинлипаза, белковые факторы систем свертывания крови, фибринолиза и кининогенеза, ренин).
Снижение активности этих ферментов в плазме будет свидетельствовать о снижении синтетической способности клеток или о накоплении ингибиторов в плазме крови. - Ферменты, не характерные для плазмы – органоспецифичные. Именно определение активности этих ферментов чаще всего используют для верификации диагноза и контроля лечения. Выделяют две группы органоспецифичных ферментов:
1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
Например,
- при изменениях со стороны сердечной мышцы происходит повышение активности сердечного изофермента креатинкиназы (КК-MB), изоферментов лактатдегидрогеназы 1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы,
- нарушения скелетных мышц – мышечного изофермента креатинкиназы (КК-MM), алкогольдегидрогеназы,
- костной ткани – щелочной фосфатазы (ЩФ), альдолазы (АЛД),
- предстательной железы – кислой фосфатазы,
- гепатоцитов – аланинаминотрансферазы, глутаматдегидрогеназы, холинэстеразы, сорбитолдегидрогеназы,
- желчевыводящих путей – щелочной фосфатазы, γ-глутамилтранспептидазы (γ-ГТП).
2. Ферменты, экскретируемые в выводные протоки желчных путей, панкреатические и слюнные протоки. В норме активность таких ферментов в плазме намного ниже, чем в клетках и имеет постоянное значение (α-амилаза, липаза поджелудочной железы). Изучение активности этих ферментов позволяет судить о функционировании соответствующего органа.
Единицы измерения активности ферментов
Активность ферментов выражают в каталах (1 катал = 1 моль/с), в единицах активности (1 Е = мкмоль/мин или 1 U, 1 unit — стандартная международная единица фермента), в производных от других единиц измерения (моль/с×л, мкмоль/с×л, мкмоль/ч×мл, мг/ч×мл, в мккат/л).
Источник
Определение активности ферментов (энзимов) в сыворотке имеет важное значение в диагностике заболеваний
На чем основано использование внутриклеточных ферментов (Ф) в диагностике?
 Небольшие количества внутриклеточных Ф присутствуют в крови в результате нормального оборота клеток. При возникновении повреждения клеток, количество освобождаемых молекул Ф увеличивается и их концентрации в крови растет (рис.1). Увеличение энзимов (Э) в плазме не всегда связано с повреждением тканей. Другие возможные причины включают в себя:
Небольшие количества внутриклеточных Ф присутствуют в крови в результате нормального оборота клеток. При возникновении повреждения клеток, количество освобождаемых молекул Ф увеличивается и их концентрации в крови растет (рис.1). Увеличение энзимов (Э) в плазме не всегда связано с повреждением тканей. Другие возможные причины включают в себя:
- увеличение оборота клеток
- клеточная пролиферация (например, рак)
- повышенный синтез Э (индукция Ф)
- препятствие секреции из органа.
Как определяют и выражают уровень ферментов в плазме при диагностике?
При анализе Э обычно измеряют каталитическую активность Ф, а не концентрацию самого белка Ф. Каталитическая активность выражается в международных единицах. Одна международная единица представляет собой количество Е, которое преобразовывает один микромоль субстрата в минуту на литр образца и сокращается как МЕ. Иногда активность выражают в каталах. Катал определяется как количество моль превращенного субстрата в секунду на литр образца.
При расшифровке результатов анализов активности ферментов в диагностике необходимо сравнивать полученные результаты только с нормальными диапазонами лаборатории, которая выдала анализы.
Основные ферменты, используемые в диагностике
| Ферменты в диагностике | Содержится | Применяется |
Аспартатаминотрансфераза (АСТ) Аланинаминотрансфераза (АЛТ) | Скелетные мышцы, сердце, печень Печень | В диагностике — заболевания печени, инфаркт миокарда |
Амилаза | слюнные железы, поджелудочная железа | Острый панкреатит |
Креатинкиназа (КФК) | Скелетные мышцы, сердце | В диагностике — инфаркт миокарда Заболевания мышц |
Гаммаглутамилтранспептидаза (ГГТП) | Печень | В диагностике — гепатобилиарная система, злоупотребление алкоголем |
Лактат дегидрогеназа (изоферменты)) | Сердце, печень, скелетные мышцы, эритроциты, тромбоциты, лимфоциты | Пренхиматозные заболевания печени, маркер опухолей |
Липаза | Поджелудочная железа | Заболевания поджелудочной железы |
Кислая фосфатаза (КФ) | Простата | В диагностике — рак простаты, метастазы в простату |
Щелочная фосфатаза (ЩФ) изоферменты | Сердце, печень, скелетные мышцы, эритроциты, тромбоциты, лимфоциты | Гепатобилиарные заболевания, заболевания костей |
5- нуклеотидаза (5-НК) | Печень | В диагностике — гепатобилиарные заболевания |
Холинэстераза | Печень | ФОС пестициды, парехиматозные заболевания печени |
Трипсин | Поджелудочная железа | В диагностике — заболевания поджелудочной железы |
Недостатки использования ферментов в диагностике
Основным недостатком определения активности Э плазмы в диагностики повреждения тканей является отсутствие у них специфичности к конкретной ткани или типу клеток. Многие Ф. являются общими для более чем одной ткани. В некоторой степени эта проблема может решается следующим образом
- Определение более одного энзима. Многие Ф. широко распространены, но их относительные концентрации могут варьироваться в разных тканях. Например, хотя АЛТ и АСТ в изобилии содержаться в печени, в сердечной мышце концентрация АСТ намного больше, чем АЛТ.
- Определение изоферментов. Некоторые ферменты существуют в более чем одной молекулярной форме.Изоферменты катализируют одну и туже реакцию, но отличаются некоторыми свойствами, характерными для той или иной ткани. На основании различных физических или химических свойств изоферметов определяют источник выхода фермента в кровь. Например, изофермент КФК МВ характерен мышцы сердца, ММ — для поперечнополосатых мышц, ВВ -изофермент — ткани мозга.
3. Определение уровня ферментов в динамике. Скорость изменения активности фермента в плазме отражает баланс между скоростью его эмиссии в кровь и скоростью удаления из циркуляции. Постоянно повышенная активность фермента в плазме наводит на мысль о хроническом заболевании или иногда нарушенного клиренса.
Источник
По
функции белки-ферменты плазмы крови
делят на:
1. собственно
ферменты плазмы — выполняют специфичные
метаболические функции в плазме. система
комплемента, система регуляции
сосудистого тонуса и некоторые другие;
2. ферменты,
поступающие в плазму в результате
повреждения того или иного органа, той
или иной ткани в результате разрушения
клеток. Обычно не выполняют в плазме
метаболическую функцию.
Органические
небелковые соединения плазмы:
I
группа — азотсодержащие небелковые
компоненты —(остаточный азот): азот
мочевины (50%); азот аминокислот (25%);
низкомолекулярные пептиды (некоторые
гормоны); креатин; креатинин; билирубин.
II
группа — безазотистые органические
вещества: углеводы, липиды и продукты
их метаболизма; минеральные вещества
крови.
При
воспалительных процессах из клетки в
первую очередь выходят цитоплазматические
ферменты, при прогрессировании
заболевания наблюдается некроз клеток
и происходит разрушение органелл-митохондрий
и лизосом. Например,(АЛТ, АлАТ) локализована
в цитоплазме, а(АСТ, АсАТ) и в цитоплазме,
и в митохондриях.
Повышение
активности в сыворотке крови может
быть результатом ускорения процессов:
• синтеза
– щелочная фосфатаза при рахите,
гепатите,
• некроза
клеток – АлАТ, АсАТ, ЛДГ, КК при инфаркте
миокарда, кислая фосфатаза при аденоме
простаты, липаза, амилаза при панкреатитах,
• понижения
выведения – щелочная фосфатаза при
желчнокаменной болезни,
• повышения
проницаемости клеточных мембран –
АлАТ, АсАТ, ЛДГ при гепатите.
Ферменты
сыворотки крови
Ферменты,
секретируемые в плазму, и выполняющие
в ней специфические функции –
истинноплазменные ферменты. Снижение
активности свидетельствовать о снижении
синтетической способности клеток.
Ферменты,
не характерные для плазмы –
органоспецифичные. Именно определение
активности этих ферментов чаще всего
используют для верификации диагноза
и контроля лечения:
1.Ферменты
клеточного метаболизма– их активность
резко повышается в плазме крови в случае
нарушения проницаемости клеточных
мембран или их альтерации:
Например,
при
изменениях со стороны сердечной мышцы
происходит повышение активности
сердечного изофермента креатинкиназы
(КК-MB), изоферментов лактатдегидрогеназы
1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы,нарушения
скелетных мышц – мышечного изофермента
креатинкиназы (КК-MM), алкогольдегидрогеназы,костной
ткани – щелочной фосфатазы (ЩФ),
альдолазы (АЛД),гепатоцитов
– аланинаминотрансферазы,
глутаматдегидрогеназы, холинэстеразы,
сорбитолдегидрогеназы,желчевыводящих
путей – щелочной фосфатазы,
γ-глутамилтранспептидазы (γ-ГТП).
2.
Ферменты, экскретируемые в выводные
протоки желчных путей, панкреатические
и слюнные протоки. В норме активность
таких ферментов в плазме намного ниже,
чем в клетках и имеет постоянное значение
(α-амилаза, липаза поджелудочной железы).
Изучение активности этих ферментов
позволяет судить о функционировании
соответствующего органа.
Единицы
измерения активности ферментов
Активность
ферментов выражают в каталах (1 катал
= 1 моль/с)
Соседние файлы в предмете Биохимия
- #
- #
27.01.202069.31 Кб0BKh_28-45.odt
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Фермент – это белок специфического характера. Он синтезируется клетками, увеличивает скорость биохимических реакций, что происходят в человеческом теле, но сам не меняется. Не будет лишним отметить, что даже малейшая реакция в организме не проходит без активного участия ферментных соединений.
Структура соединений
В молекулярной характеристике ферменты плазмы крови делятся на сложные и простые. Первые ферменты состоят из белкового (апоэнзима или апофермента) и небелкового компонента (коэнзима или кофермента). В роли коэнзима выступают витамины и металлы. В сравнении с апоэнзимом, кофермент намного меньше по размерам. Активность его напрямую зависит от молекулы, которая обеспечивает нужное расположение аминоклислот. На это влияют:
- Видовые и концентрационные особенности объекта, на который нацелено действие фермента.
- Температурные показатели.
- рН среды.
- Присутствие или отсутствие веществ, которые препятствуют работе ферментов.
Особую важность несут два последних показателя, поскольку любая реакция требует своих специальных условий.
Характеристики ферментных соединений
Отличительная черта ферментов заключается в их способности сотрудничать с одним или группой субстратов, только если они имеют похожее строение. Они могут менять активность из-за присутствия в организме инфекций и вирусов, но эти показатели нельзя считать симптомами патологических процессов.
Благодаря этому определение уровня активности данного белка несет диагностическое значение только в том случае, если отмечены изменения в других показателях. Пока что биохимии известно о происхождении приблизительно 1000 энзимов, 65 из которых систематически используются в диагностических лабораториях.
Для каждого органа человеческого тела характерен оригинальный ферментный набор. Узнав их активность, можно получить общую картину о его работе. Такой диагностический метод применяется для проверки состояния сердца, печени и опорно-двигательного аппарата тела.
Классификация ферментов
В кровяной сыворотке присутствуют две большие ферментные группы – плазменные и органоспецифические. Рассмотрим детально каждую группу.
Плазменные
Так называются соединения, которые поступают в плазму и выполняют в ней некоторые действия. Здесь уровень их активности в несколько раз больше, нежели в органах. К плазмоспецифическим соединениям относят:
- Липопротеинлипазу.
- Кининогеназу.
- Церулоплазмин.
- Ренин.
- Фибриназу.
- Псевдохолинэстеразу.
- Белковые элементы системы, обеспечивающей свертываемость крови.
Важно! Если активные показатели вышеперечисленных веществ ниже нормы, это может быть вызвано пониженным синтезом ферментов или высокой концентрацией в организме ингибиторов.
Органоспецифические соединения
Эти ферменты делятся на две категории:
- Поддерживающие клеточный метаболизм. Их еще называют индикаторными ферментами плазмы крови. Индикаторные соединения появляются в плазме, если в организме нарушена проницаемость мембран клеток или произошли другие изменения в их структуре. Диагностировать эти процессы можно по показателям креатин-фосфокиназы, аминотранферазы и лактатдегидрогеназы.
- Экскреторные ферменты плазмы крови. Нормальные показатели активности этих соединений в крови, по сравнению с тканями органов ЖКТ, в которых они синтезируются, , значительно ниже, но отличаются постоянством показателей. К секретируемым ферментам относят α‑амилазу и липазу поджелудочной железы. Если анализ пациента показал повышенную концентрацию вышеописанных веществ, это можно расценивать как проявление патологии соответствующих органов.
- Секреторные. Синтезируются печенью, кишечником, сосудами, потом поступаю в плазму крови. Сюда относятся ферменты. обеспечивающие работу свертывающей и противосвертывающей системы крови.
Почему изменяется активность кровяных ферментов
Уровень изменения концентрации ферментов клеточного обмена веществ в плазме напрямую связан с размером пораженной ткани или органа, тканевоспецефического деления этих белков и их накопления в клетках. Если в теле развивается воспаление, клетка, прежде всего, выводит цитоплазматический фермент. При усилении воспаления начинается клеточный некроз. Из-за этого в сыворотку попадают ферменты лизосом и митохондрий. К примеру, аланинаминотрансфераза (АлАТ или АЛТ) локализуется в цитоплазме, аспартатаминотрансфераза (АлАТ или АЛТ) одновременно локализуется в цитоплазме и митохондриях.
Чрезмерная деятельность ферментов крови нередко сигнализирует о скорости:
- Синтеза щелочной фосфотазы при гепатитах и рахите.
- Отмирания клеток КК, АсАТ, ЛДГ и АлАТ в случае инфаркта миокарда, кислой фосфотазы при аденоме простаты, амилазы и липазы при панкреатите.
- Проницаемости клеток АлАТ, ЛДГ и АсАТ при гепатитах.
Сниженная активность ферментов спровоцирована:
- Снижением количества клеток, которые секретируют фермент (холинэстераза при циррозе печени).
- Недостаточным синтезом или ускоренным выводом ферментов.
- Замедленной активностью из-за влияния протеиназ.
В некоторых случаях для диагностики важную роль играет выяснение взаимосвязи между сменой индикатора активности некоторых ферментных групп и данными о своеобразных ферментных спектрах крови. На основе этого конститутивного анализа специалист может распознать точные ферментативные признаки ряда болезней. К таким относится:
- Острый гепатит. Это заболевание стимулирует активность аланин- и аспартатаминотрансферазы, альдопазы.
- Инфаркт миокарда. Из-за этого недуга лактатдегидрогеназа, аспартатаминотрансфераза и креатинкиназа стремительно увеличивают свою активность.
- Механическая желтуха. Провоцирует увеличение концентрации щелочной фосфотазы на фоне незначительной активности альдолазы и аминотрансферазы.

Важность показателя АсАТ
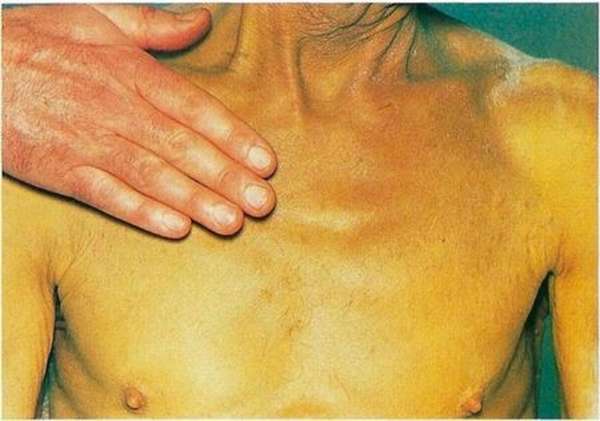
Повышение концентрации в плазме крови этого фермента может расцениваться как предвестник:
- Инфаркта миокарда.
- Гепатита.
- Начальных стадий стенокардии.
- Панкреатита.
- Раковых патологий печени.
- Ревмокардита.
- Чрезмерных силовых нагрузок.
- Сердечной недостаточности.
Учитывая происхождение ферментов плазмы крови, АСТ может повышаться из-за травмированной мышечной ткани, мощного теплового удара или как побочный эффект после кардиохирургического оперативного вмешательства.
Пониженный показатель АСТ может сигнализировать о:
- Дефиците в организме витаминов.
- Осложнениях после тяжелых инфекционных и вирусных заболеваниях.
- Разрыве печени.
Обратите внимание! У женщин допустимый показатель АСТ – до 32 Ед/л, у мужчин – до 43 Ед/л.
Важность показателя альдолазы
Это соединение обеспечивает в человеческом организме правильное протекание энергетического обмена. Альдолаза считается тканевоспецифическим ферментом, поскольку присутствует во всех тканях нашего тела. Допустимые показатели для взрослого человека – не более 3,3 U/1.
Если в таблице анализа зафиксирована усиленная активность альдолазы, спровоцировать это может:
- Инфаркт.
- Травмированная мышечная ткань.
- Инфекционные, вирусные и механические заболевания печени.
- Панкреатит.
- Новообразование злокачественного характера.
- Воспаление и распад мышечных волокон.
- Гемолитическая анемия.
- Инфекционный мононуклеоз.
- Запущенная стадия воспаления легких.
- Шизофрения.
- Чрезмерная силовая нагрузка.

Почему важен показатель СДГ
Сорбитолдегидрогеназами называются индикационные ферменты плазмы крови, главным центром локации которой является печень. Если показатели СДГ завышены, специалист может сразу расценить это как клинический симптом печеночных патологий. По мировым стандартам биохимия плазмы крови на ферменты СДГ должна показать активность 1-3 ЕД/л.
На повышенную активность СДГ влияет:
- Острая стадия вирусного гепатита.
- Резкое обострение гепатита хронического характера.
- Печеночная кома.
- Обтурационная желтуха.
Влияние простатической кислой фосфатазы
Местом происхождения и локализации КФ считается предстательная железа (ПЖ). Если на результате анализа крови зафиксирована активная деятельность этого фермента, пациенту могут диагностировать:
- Раковую опухоль предстательной железы, которая уже запустила метастазы.
- Доброкачественную гипертрофию простаты.
- Простатит.
- Инфарктное поражение ПЖ.
- Осложнение от лечения простаты.
На многих примерах доказано, этот индикационный фермент не проявляет большую активность на ранних стадиях любых заболеваний ПЖ. Именно поэтому специалисты предпочитают проводить анализ на работу КФ уже после определения диагноза. Цель этого действия – контролировать результат терапевтических мероприятий.
Проверяем глюкозо-6-фосфатдегидрогеназу
Фермент Г-6-ФДГ локализуется в эритроцитах и проявляет бурную активность в новообразовавшихся клетках. Если у пациента диагностировали наследственное нарушение допустимых показателей, со временем он будет страдать от гемолитических кризисов.
В медицине установлено, что нормальная активность этого фермента может колебаться в пределах 123-244 мЕД/млрд эритроцитов.
Если эритроциты будут испытывать дефицит данного фермента, у пациента в скором времени проявится гемолитическая анемия.
Загрузка…
Источник

