Цитохимический анализ крови в инвитро
Метод определения
Гистологическое исследование биоптата согласно гистологической классификации Всемирной организации здравоохранения (ВОЗ) с окрашиванием гематоксилином-эозином.
ИГХ-исследование с применением спектра антител (до пяти антител) (пероксидазный и авидин-биотиновый методы).
Исследуемый материал
Смотрите в описании
Комплексное исследование биоптатов при лимфопролиферативных заболеваниях, включающее морфологическое описание и оценку экспрессии спектра опухолевых маркеров, для определения тактики лечения и прогноза.
Лимфомы относят к заболеваниям кроветворной ткани – гемобластозам, среди которых выделяют лейкозы и гематосаркомы. Для лимфом характерно развитие очаговых опухолевых разрастаний из элементов кроветворной ткани без поражения костного мозга (лимфатического узла) на ранних стадиях. Этиология лимфом окончательно не установлена. Риск развития неходжкинских лимфом ассоциируется с инфекционными агентами (вирусом Эпштейна-Барр (ВЭБ), вирусом иммунодефицита человека (ВИЧ), человеческим Т-клеточным лимфотропным вирусом типа I), факторами внешней среды (ионизирующим излучением, пестицидами), первичным и вторичным (ятрогенным) иммунодефицитом, аутоиммунными заболеваниями.
В соответствии с российскими клиническими рекомендациями по диагностике и лечению лимфопролиферативных заболеваний (2013), диагноз устанавливают на основании морфологического исследования биопсийного или операционного материала с помощью гистологических и иммуногистохимических методов. Морфологическое исследование должно выполняться патологом-экспертом и соответствовать критериям текущей классификации Всемирной организации здравоохранения (ВОЗ). Объем иммуногистохимического исследования определяет врач-патологоанатом при гистологическом изучении биоптата. В отдельных случаях проводятся молекулярно-биологическое и генетическое исследования. Цитологическое исследование пунктатов или мазков-отпечатков лимфоузла или других опухолевых очагов не является достаточным основанием для нозологической верификации лимфом.
Пункционная биопсия или трепанобиопсия опухоли с диагностической целью могут быть выполнены только в исключительных случаях при необходимости немедленного лечения.
Дифференциальная диагностика наиболее часто встречающихся лимфом с учетом классификации ВОЗ (2008) и российских клинических рекомендаций по диагностике и лечению лимфопролиферативных заболеваний (2013).
1. Лимфома Ходжкина
Заболеваемость лимфомой Ходжкина (ЛХ) в России составляет 2,1 случая на 100 тысяч населения в год. Заболевание возникает в любом возрасте, но преимущественно в интервале 16-35 лет, в этой возрастной группе в России преобладают женщины. Критерии диагноза: все варианты классической ЛХ характеризуются единым иммунофенотипом: CD30+, CD15+, PAX-5+. В опухолевых клетках может обнаруживаться вирус Эпштейна-Барр (LMP1/EBER).
2. Фолликулярная лимфома
Фолликулярная лимфома (ФЛ) занимает второе место по частоте всех злокачественных лимфопролиферативных заболеваний взрослых. Этот показатель значительно варьирует в разных географических регионах, зависит от этнической и расовой принадлежности больных. Медиана возраста пациентов составляет 60 лет, соотношение мужчин и женщин приблизительно 1:1,7. Иммунофенотип: В-клеточная лимфома с иммунофенотипом CD20+, CD10+/-, BCL-2+, BCL-6+, CD3-, CD5-, CD23+/-, CD43-, сyclin D1-. В редких случаях ФЛ может быть BCL-2-негативная. В таком случае рекомендовано цитогенетическое исследование для выявления t(14;18) или реаранжировки BCL-2. Пролиферативный индекс обычно не превышает 20%, Ki-67 > 30% ассоциируется с неблагоприятным прогнозом.
3. Лимфома маргинальной зоны
Лимфомы маргинальной зоны (ЛМЗ) представляют собой группу злокачественных В-клеточных новообразований, происходящих из В-лимфоцитов, которые в норме встречаются в маргинальной зоне в фолликулах лимфатических узлов (ЛУ), селезенки и лимфатических тканей. Выделяют три типа ЛМЗ:
- нодальную лимфому;
- экстранодальную MALT (Mucosa-Associated Lymphoid Tissue – мукозоассоциированную) лимфому;
- лимфому селезенки.
Наиболее часто при экстранодальных MALT-лимфомах поражается желудочно-кишечный тракт (около 50% случаев). Среди органов желудочно-кишечного тракта (ЖКТ) на долю MALT-лимфомы желудка приходится до 80% случаев. Существует доказанная связь между инфицированностью Helicobacter pylori и MALT-лимфомой желудка, Borrelia burgdorferi и ЛМЗ кожи, Chlamydophila psittaci и ЛМЗ орбиты, Campylobacter jejuni и IPSID (Immunoproliferative Small Intestine Disease – иммунопролиферативным заболеванием тонкой кишки), вирусом гепатита С и ЛМЗ селезенки и негастральными MALT-лимфомами. Иммунофенотип: иммунофенотип нодальных и экстранодальных В-клеточных лимфом из клеток маргинальной зоны идентичен: CD20+, CD5-, CD10-, CD23-, BCL-2+/-, BCL-6-, MUM 1+. В сложных случаях при преобладании диффузного роста рекомендуется дополнительное исследование экспрессии CD38(-) и CD44(+).
4. Диффузная крупноклеточная
В-клеточная лимфома Диффузная крупноклеточная B-клеточная лимфома (ДВКЛ) является наиболее распространенным вариантом лимфом взрослых (30% от всех неходжкинских лимфом). Заболеваемость составляет 4-5 случаев на 100 тысяч населения в год. Риск развития болезни увеличивается с возрастом (медиана заболеваемости – 63 года). Мужчины и женщины болеют почти с равной частотой. Иммунофенотип: экспрессия пан-В-клеточных антигенов CD20+, CD79a+, PAX 5+, CD45+, CD3-. ДВКЛ, как правило, характеризуется высокой митотической и пролиферативной активностью. Ki-67 экспрессируется в широком диапазоне: от 40 до 90%, в отдельных наблюдениях превышает 90%. При наличии технической возможности в алгоритм диагностики может включаться генетическое исследование с определением наличия перестройки генов MYC (до 10% случаев), BCL-6 (до 30% случаев), t(14;18)(q32;q21).
5. Лимфома из клеток мантии
Лимфома из клеток мантии (ЛКМ) составляет около 6% от числа лимфатических опухолей. Болеют преимущественно пожилые мужчины (медиана заболеваемости – 65-75 лет, соотношение мужчин и женщин – 3:1). Опухоль клинически и морфологически гетерогенна, в большинстве случаев (70-80%) в дебюте выявляется генерализованное поражение ЛУ, селезенки и экстранодальных областей. Это агрессивная лимфома, при которой общая выживаемость больных составляет 3-5 лет. Заболевание характеризуется коротким временем до прогрессирования, первый рецидив обычно химиорезистентен. Иммунофенотип: CD20+, CD5+/CD43+, сyclin D1+, BCL-2+, CD3-, CD23- (редкие случаи ЛКМ могут экспрессировать CD10, CD23, BCL-6). Индекс пролиферации менее 30%, как правило, ассоциируется с благоприятным течением заболевания, при бластоидном варианте он может достигать 80-90%. В сложных диагностических случаях целесообразно выполнение цитогенетического/FISH-исследования для выявления t(11;14). В редких случаях при типичной клинической и иммуноморфологической картине отсутствуют t(11;14)(q13;q32) и гиперэкспрессия сyclin D1, имеется гиперэкспрессия cyclin D2 или cyclin D3. В случаях cyclin D1-негативных лимфом из клеток мантии можно дополнительно использовать антитела к p27.
6. Нодальные Т-клеточные лимфомы
Редкая группа заболеваний, которая характеризуется патобиологической гетерогенностью и составляет около 15% от всех лимфом. Вне зависимости от особенностей своего развития и течения, за редким исключением, это агрессивные лимфомы с плохим прогнозом. Наиболее распространенные формы: — периферическая Т-клеточная лимфома. Иммунофенотип: CD2+, CD3+, CD4+, CD5+, CD7+, CD8+, с признаками аберрантности иммунофенотипа (утратой некоторых из них), часть клеток может экспрессировать CD30. — ангиоиммунобластная Т-клеточная лимфома. Иммунофенотип: опухолевые клетки экспрессируют пан-Т-клеточные маркеры, CD4+ преобладают над CD8+. Возможна утрата какого-либо из пан-Т-клеточных антигенов как проявление аберрантного фенотипа. Вариабельное количество опухолевых Т-клеток экспрессирует CD10, BCL6. Наиболее специфичным, но менее чувствительным маркером для данного варианта лимфомы является наличие антител к CXCL13. — анапластическая крупноклеточная лимфома (АККЛ). Иммунофенотип: ключевым иммунофенотипическим признаком является экспрессия CD30 и полиморфная/анаплазированная морфология. Опухолевые клетки имеют аберрантный фенотип с утратой некоторых Т-клеточных антигенов. В части случаев не удается доказать Т-клеточный иммунофенотип (так называемые 0-клеточные АККЛ). Часто обнаруживается экспрессия цитотоксических молекул (TIA-1, granzyme В, perforin). Экспрессия CD45 и EMA вариабельна.
7. Хронический лимфолейкоз
Хронический лимфолейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых. Частота его в европейских странах составляет 4:100 тысяч населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30:100 тысяч человек в год. Медиана возраста на момент установления диагноза в европейских странах – 69 лет. В России ХЛЛ выявляется реже и медиана возраста на момент установления диагноза меньше, соразмерно меньшей продолжительности жизни россиян. Иммунофенотип: ХЛЛ характеризуется гетерогенной экспрессией CD20, коэкспрессией CD5, CD23, CD43.
Материал для исследования: биоптат опухоли, фиксированный в забуференном 10% растворе формалина .
Литература
- Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2007 г. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2009;20(3):8-138.
- Научная библиотека диссертаций и авторефератов disserCat https://www.dissercat.com/content/morfologicheskaya-i-immunogistokhimicheskaya-differentsialnaya-diagnostika-limfomy-khodzhkin#ixzz41vK9JJCf.
- Росcийские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под руководством профессора И.В. Поддубной, профессора В.Г. Савченко. — М.: Изд. «Медиа Медика».2013. https://npngo.ru/Attachments/SiteContent/Recomendacii.pdf.
- Behringer K., Thielen I., Mueller H. et al. Fertility and gonadal function in female survivors after treatment of early unfavorable Hodgkin lymphoma (HL) within the German Hodgkin Study Group HD14 trial. Annals of Oncology. 2012;23(7):1818-1825.
- Buske C., Hoster E., Dreyling M. et al. The Follicular Lymphoma International Prognostic Index (FLIPI) separates high risk from intermediate or low risk patients with advanced stage follicular lymphoma treated front-line with Rituximab and the combination of Cyclophosphamide, Doxorubicin, Vincristine and Prednisone (R-CHOP) with respect to treatment outcome. Blood. 2006;108:1504-1508.
- Engert A., Haverkamp H., Kobe C. et al. Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin’s lymphoma (HD15 trial): a randomised, open-label, phase 3 non-inferiority trial. Lancet. 2012;379(9828):1791-1799.
- Engert A., Plutschow A., Eich H.T. et al. Reduced treatment intensity in patients with early-stage Hodgkin’s lymphoma. New England Journal of Medicine. 2010;363:640-642.
- Federico M., Bellei M., Marcheselli L. et al. Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project. Journal of Clinical Oncology. 2009;27:4555-4652.
- Harris N.L., Stein H., Sarah E. et al. New approaches to lymphoma diagnosis. Hematology. 2001:194-220.
- Meyer R.M., Gospodarowicz M.K., Connors J.M. et al. ABVD Alone versus Radiation-Based Therapy in Limited-Stage Hodgkin’s Lymphoma. New England Journal of Medicine. 2012;366:399-408.
- Nogova L., Reineke T., Brillant C. et al. Lymphocyte-predominant and classical Hodgkin’s lymphoma: a comprehensive analysis from the German Hodgkin Study Group. Journal of Clinical Oncology. 2008;26:434-439.
Источник
Метод определения
Гистологическое исследование биоптата согласно гистологической классификации Всемирной организации здравоохранения (ВОЗ) с окрашиванием гематоксилином-эозином.
ИГХ-исследование с применением спектра тканеспецифичных и прогностических антител (до пяти антител) (пероксидазный и авидин-биотиновый методы).
Исследуемый материал
Смотрите в описании
Комплексное исследование биоптатов метастатических образований различных локализаций, включающее морфологическое описание и оценку экспрессии спектра тканевых маркеров, для определения гистогенеза первичного опухолевого очага.
По статистике, в 3-15% случаев злокачественные опухоли манифестируют метастазами. Метастазы без выявленного первичного очага характеризуются случайной, нетипичной локализацией и быстрым прогрессированием процесса. Средняя продолжительность жизни пациентов с тремя и более метастатическими очагами поражения составляет три месяца. При этом локализация первичного очага у 60-70% пациентов выявляется только на аутопсии. Своевременная ИГХ-диагностика определяет тактику лечения до выявления первичного очага.
Патоморфологическая диагностика метастазов невыявленных опухолей предусматривает определение их морфологического типа, уточнение вероятного источника метастазирования, оценку злокачественного потенциала. Первая задача решается при рутинном гистологическом исследовании биопсийного материала (окрашивание гематоксилином-эозином), вторая – применением специальных методов исследования: гистохимического, иммуногистохимического (ИГХ) или молекулярно-генетического метода FISH (Fluorescence In Situ Hybridization).
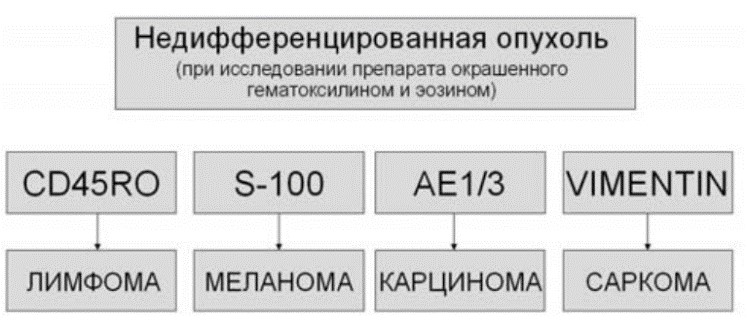
При рутинной морфологической диагностике метастатические опухоли, согласно рекомендациям Европейского общества медицинской онкологии ESMO (European Society for Medical Oncology) (2004), разделяются на пять крупных категорий: аденокарцинома, плоскоклеточный рак, нейроэндокринный рак, недифференцированный рак, недифференцированная опухоль. Эти морфологические категории, наряду с данными о распространенности процесса, во многих случаях позволяют определить адекватный план обследования (и лечения). Так, например, при выявлении метастаза плоскоклеточного рака в шейных лимфатических узлах необходимо эндоскопическое обследования органов верхних дыхательных и пищеварительных путей. ИГХ-исследование, в зависимости от морфологического типа новообразования, позволяет уточнить гистогенез опухоли и/или определить вероятную локализацию первичного очага.
Для ИГХ-исследования первичных опухолей и их метастазов используется широкий спектр тканеспецифичных маркеров: -цитоспецифичные (кластеры дифференцировки лейкоцитов (CD – Clusters of Differentiation), гладкомышечный актин, миоглобин, тиреоглобулин); -маркеры пролиферации (Ki67, PCNA – Proliferating Cell Nuclear Antigen); -опухолевые маркеры – онкофетальные антигены (фетопротеин, карциноэмбриональный антиген); -гормоны (эстроген, прогестерон); -ферменты, белковые продукты клеточных онкогенов и др.
Единых алгоритмов при ИГХ-исследовании метастазов опухолей без уточненного первичного очага не разработано. Корректное определение направления дифференцировки опухолевых клеток и ряда биологических параметров опухоли само по себе является показанием для назначения определенных схем терапии. Например, обнаружение метастазов аденокарциномы в лимфоузлах подмышечной области может являться показанием к проведению терапии, аналогичной терапии рака молочной железы соответствующей стадии. Обнаружение экспрессии рецепторов эстрогенов и прогестерона в такой аденокарциноме может стать показанием к назначению антигормональной терапии вне зависимости от наличия определяемого опухолевого узла в молочной железе. Пример алгоритма, рекомендуемого для использования в дифференциальной диагностике.

Материал для исследования: биоптат опухоли, фиксированный в парафиновом блоке.
Литература
- Blaszyk H., Hartmann A., Bjornsson J. Cancer of unknown primary: clinicopathologic correlations. APMIS. 2003;111(12):1089-1094.
- Dabbs D.J. Diagnostic Immunohistochemistry: Theranostic and Genomic Applications. Elsevier, 4-th Edition. 2013:960.
- Di Patre P.L., Carter D. Sternberg’s Diagnostic Surgical Pathology Review. Wolters Kluver, 2-nd Edition. 2015:488.
- Dietal M., Wittekind С., Bussolati G., von Winterfeld М. Pre-Analytics of Pathological Specimens in Oncology. Sрringer. 2015:133.
- Dodd L.G, Bui M.М. Atlas of Soft Tissue and Bone Pathology. DemosMEDICAL. 2014:720.
- Edge S.B, Byrd D.R., Compton C.C., Fritz A.G., Greene F.L., Trotti A. AJCC Cancer Staging Manual. Sрringer, 7-th Edition. 2011:646.
- Elder D.E. Lever’s Histopathology of the Skin. Wolters Kluver, 11-th Edition. 2014:1544.
- Epstein J., Netto G. Biopsy Interpretation of the Prostate. Lippincott Williams and Wilkins, 5-th Edition. 2014:450.
- Erickson L. Atlas of Endocrine Pathology. Sрringer, 1-st Edition. 2014:178.
- ESMO Minimum Clinical Recommendations for diagnosis, treatment and follow-up of cancers of unknown primary site. Annals of Oncology. 2005;16(S.1):175-176.
- Fletcher C.D.M., Bridge J.A., Hogendoorn P., Mertens F. WHO Classification of Tumours of Soft Tissue and Bone. WHO Press, 4-th Edition. 2013;5:427.
- Kurman R.J., Carcangiu M.L., Herrington C.S., Young R.H. WHO Classification of Tumours of the Female Reproductive Organs. WHO Press, 4-th Edition. 2014;4:316.
- Louis D.N., Ohgaki H., Wiestler O.D., Cavenee W.K. WHO Classification of Tumours of the Central Nervous System. WHO Press, 4-th Edition. 2007;1:312.
- Malpica A., Euscher Е.D. Biopsy Interpretation of the Uterine Cervix and Corpus. Wolters Kluver, 2-nd Edition. 2015:368.
- Nishizuka S., Chen S.T., Gwadry F. et al. Diagnostic markers that distinguish colon and ovarian adenocarcinomas: identification by genomic, proteomic, and tissue array profiling. Cancer Research. 2003;63:5243-5250.
- Nordi Q.C. https://www.nordiqc.org.
Источник
Метод определения
Гистологическое исследование биоптата согласно гистологической классификации Всемирной организации здравоохранения (ВОЗ) с окрашиванием гематоксилином-эозином.
ИГХ-исследование с применением спектра антител (до пяти антител) (пероксидазный и авидин-биотиновый методы).
Исследуемый материал
Смотрите в описании
Комплексное исследование биоптатов при лимфопролиферативных заболеваниях, включающее морфологическое описание и оценку экспрессии спектра опухолевых маркеров, для определения тактики лечения и прогноза.
Лимфомы относят к заболеваниям кроветворной ткани – гемобластозам, среди которых выделяют лейкозы и гематосаркомы. Для лимфом характерно развитие очаговых опухолевых разрастаний из элементов кроветворной ткани без поражения костного мозга (лимфатического узла) на ранних стадиях. Этиология лимфом окончательно не установлена. Риск развития неходжкинских лимфом ассоциируется с инфекционными агентами (вирусом Эпштейна-Барр (ВЭБ), вирусом иммунодефицита человека (ВИЧ), человеческим Т-клеточным лимфотропным вирусом типа I), факторами внешней среды (ионизирующим излучением, пестицидами), первичным и вторичным (ятрогенным) иммунодефицитом, аутоиммунными заболеваниями.
В соответствии с российскими клиническими рекомендациями по диагностике и лечению лимфопролиферативных заболеваний (2013), диагноз устанавливают на основании морфологического исследования биопсийного или операционного материала с помощью гистологических и иммуногистохимических методов. Морфологическое исследование должно выполняться патологом-экспертом и соответствовать критериям текущей классификации Всемирной организации здравоохранения (ВОЗ). Объем иммуногистохимического исследования определяет врач-патологоанатом при гистологическом изучении биоптата. В отдельных случаях проводятся молекулярно-биологическое и генетическое исследования. Цитологическое исследование пунктатов или мазков-отпечатков лимфоузла или других опухолевых очагов не является достаточным основанием для нозологической верификации лимфом.
Пункционная биопсия или трепанобиопсия опухоли с диагностической целью могут быть выполнены только в исключительных случаях при необходимости немедленного лечения.
Дифференциальная диагностика наиболее часто встречающихся лимфом с учетом классификации ВОЗ (2008) и российских клинических рекомендаций по диагностике и лечению лимфопролиферативных заболеваний (2013).
1. Лимфома Ходжкина
Заболеваемость лимфомой Ходжкина (ЛХ) в России составляет 2,1 случая на 100 тысяч населения в год. Заболевание возникает в любом возрасте, но преимущественно в интервале 16-35 лет, в этой возрастной группе в России преобладают женщины. Критерии диагноза: все варианты классической ЛХ характеризуются единым иммунофенотипом: CD30+, CD15+, PAX-5+. В опухолевых клетках может обнаруживаться вирус Эпштейна-Барр (LMP1/EBER).
2. Фолликулярная лимфома
Фолликулярная лимфома (ФЛ) занимает второе место по частоте всех злокачественных лимфопролиферативных заболеваний взрослых. Этот показатель значительно варьирует в разных географических регионах, зависит от этнической и расовой принадлежности больных. Медиана возраста пациентов составляет 60 лет, соотношение мужчин и женщин приблизительно 1:1,7. Иммунофенотип: В-клеточная лимфома с иммунофенотипом CD20+, CD10+/-, BCL-2+, BCL-6+, CD3-, CD5-, CD23+/-, CD43-, сyclin D1-. В редких случаях ФЛ может быть BCL-2-негативная. В таком случае рекомендовано цитогенетическое исследование для выявления t(14;18) или реаранжировки BCL-2. Пролиферативный индекс обычно не превышает 20%, Ki-67 > 30% ассоциируется с неблагоприятным прогнозом.
3. Лимфома маргинальной зоны
Лимфомы маргинальной зоны (ЛМЗ) представляют собой группу злокачественных В-клеточных новообразований, происходящих из В-лимфоцитов, которые в норме встречаются в маргинальной зоне в фолликулах лимфатических узлов (ЛУ), селезенки и лимфатических тканей. Выделяют три типа ЛМЗ:
- нодальную лимфому;
- экстранодальную MALT (Mucosa-Associated Lymphoid Tissue – мукозоассоциированную) лимфому;
- лимфому селезенки.
Наиболее часто при экстранодальных MALT-лимфомах поражается желудочно-кишечный тракт (около 50% случаев). Среди органов желудочно-кишечного тракта (ЖКТ) на долю MALT-лимфомы желудка приходится до 80% случаев. Существует доказанная связь между инфицированностью Helicobacter pylori и MALT-лимфомой желудка, Borrelia burgdorferi и ЛМЗ кожи, Chlamydophila psittaci и ЛМЗ орбиты, Campylobacter jejuni и IPSID (Immunoproliferative Small Intestine Disease – иммунопролиферативным заболеванием тонкой кишки), вирусом гепатита С и ЛМЗ селезенки и негастральными MALT-лимфомами. Иммунофенотип: иммунофенотип нодальных и экстранодальных В-клеточных лимфом из клеток маргинальной зоны идентичен: CD20+, CD5-, CD10-, CD23-, BCL-2+/-, BCL-6-, MUM 1+. В сложных случаях при преобладании диффузного роста рекомендуется дополнительное исследование экспрессии CD38(-) и CD44(+).
4. Диффузная крупноклеточная
В-клеточная лимфома Диффузная крупноклеточная B-клеточная лимфома (ДВКЛ) является наиболее распространенным вариантом лимфом взрослых (30% от всех неходжкинских лимфом). Заболеваемость составляет 4-5 случаев на 100 тысяч населения в год. Риск развития болезни увеличивается с возрастом (медиана заболеваемости – 63 года). Мужчины и женщины болеют почти с равной частотой. Иммунофенотип: экспрессия пан-В-клеточных антигенов CD20+, CD79a+, PAX 5+, CD45+, CD3-. ДВКЛ, как правило, характеризуется высокой митотической и пролиферативной активностью. Ki-67 экспрессируется в широком диапазоне: от 40 до 90%, в отдельных наблюдениях превышает 90%. При наличии технической возможности в алгоритм диагностики может включаться генетическое исследование с определением наличия перестройки генов MYC (до 10% случаев), BCL-6 (до 30% случаев), t(14;18)(q32;q21).
5. Лимфома из клеток мантии
Лимфома из клеток мантии (ЛКМ) составляет около 6% от числа лимфатических опухолей. Болеют преимущественно пожилые мужчины (медиана заболеваемости – 65-75 лет, соотношение мужчин и женщин – 3:1). Опухоль клинически и морфологически гетерогенна, в большинстве случаев (70-80%) в дебюте выявляется генерализованное поражение ЛУ, селезенки и экстранодальных областей. Это агрессивная лимфома, при которой общая выживаемость больных составляет 3-5 лет. Заболевание характеризуется коротким временем до прогрессирования, первый рецидив обычно химиорезистентен. Иммунофенотип: CD20+, CD5+/CD43+, сyclin D1+, BCL-2+, CD3-, CD23- (редкие случаи ЛКМ могут экспрессировать CD10, CD23, BCL-6). Индекс пролиферации менее 30%, как правило, ассоциируется с благоприятным течением заболевания, при бластоидном варианте он может достигать 80-90%. В сложных диагностических случаях целесообразно выполнение цитогенетического/FISH-исследования для выявления t(11;14). В редких случаях при типичной клинической и иммуноморфологической картине отсутствуют t(11;14)(q13;q32) и гиперэкспрессия сyclin D1, имеется гиперэкспрессия cyclin D2 или cyclin D3. В случаях cyclin D1-негативных лимфом из клеток мантии можно дополнительно использовать антитела к p27.
6. Нодальные Т-клеточные лимфомы
Редкая группа заболеваний, которая характеризуется патобиологической гетерогенностью и составляет около 15% от всех лимфом. Вне зависимости от особенностей своего развития и течения, за редким исключением, это агрессивные лимфомы с плохим прогнозом. Наиболее распространенные формы: — периферическая Т-клеточная лимфома. Иммунофенотип: CD2+, CD3+, CD4+, CD5+, CD7+, CD8+, с признаками аберрантности иммунофенотипа (утратой некоторых из них), часть клеток может экспрессировать CD30. — ангиоиммунобластная Т-клеточная лимфома. Иммунофенотип: опухолевые клетки экспрессируют пан-Т-клеточные маркеры, CD4+ преобладают над CD8+. Возможна утрата какого-либо из пан-Т-клеточных антигенов как проявление аберрантного фенотипа. Вариабельное количество опухолевых Т-клеток экспрессирует CD10, BCL6. Наиболее специфичным, но менее чувствительным маркером для данного варианта лимфомы является наличие антител к CXCL13. — анапластическая крупноклеточная лимфома (АККЛ). Иммунофенотип: ключевым иммунофенотипическим признаком является экспрессия CD30 и полиморфная/анаплазированная морфология. Опухолевые клетки имеют аберрантный фенотип с утратой некоторых Т-клеточных антигенов. В части случаев не удается доказать Т-клеточный иммунофенотип (так называемые 0-клеточные АККЛ). Часто обнаруживается экспрессия цитотоксических молекул (TIA-1, granzyme В, perforin). Экспрессия CD45 и EMA вариабельна.
7. Хронический лимфолейкоз
Хронический лимфолейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых. Частота его в европейских странах составляет 4:100 тысяч населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30:100 тысяч человек в год. Медиана возраста на момент установления диагноза в европейских странах – 69 лет. В России ХЛЛ выявляется реже и медиана возраста на момент установления диагноза меньше, соразмерно меньшей продолжительности жизни россиян. Иммунофенотип: ХЛЛ характеризуется гетерогенной экспрессией CD20, коэкспрессией CD5, CD23, CD43.
Материал для исследования: биоптат опухоли, фиксированный в парафиновом блоке .
Литература
- Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2007 г. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2009;20(3):8-138.
- Научная библиотека диссертаций и авторефератов disserCat https://www.dissercat.com/content/morfologicheskaya-i-immunogistokhimicheskaya-differentsialnaya-diagnostika-limfomy-khodzhkin#ixzz41vK9JJCf.
- Росcийские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под руководством профессора И.В. Поддубной, профессора В.Г. Савченко. — М.: Изд. «Медиа Медика».2013. https://npngo.ru/Attachments/SiteContent/Recomendacii.pdf.
- Behringer K., Thielen I., Mueller H. et al. Fertility and gonadal function in female survivors after treatment of early unfavorable Hodgkin lymphoma (HL) within the German Hodgkin Study Group HD14 trial. Annals of Oncology. 2012;23(7):1818-1825.
- Buske C., Hoster E., Dreyling M. et al. The Follicular Lymphoma International Prognostic Index (FLIPI) separates high risk from intermediate or low risk patients with advanced stage follicular lymphoma treated front-line with Rituximab and the combination of Cyclophosphamide, Doxorubicin, Vincristine and Prednisone (R-CHOP) with respect to treatment outcome. Blood. 2006;108:1504-1508.
- Engert A., Haverkamp H., Kobe C. et al. Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin’s lymphoma (HD15 trial): a randomised, open-label, phase 3 non-inferiority trial. Lancet. 2012;379(9828):1791-1799.
- Engert A., Plutschow A., Eich H.T. et al. Reduced treatment intensity in patients with early-stage Hodgkin’s lymphoma. New England Journal of Medicine. 2010;363:640-642.
- Federico M., Bellei M., Marcheselli L. et al. Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project. Journal of Clinical Oncology. 2009;27:4555-4652.
- Harris N.L., Stein H., Sarah E. et al. New approaches to lymphoma diagnosis. Hematology. 2001:194-220.
- Meyer R.M., Gospodarowicz M.K., Connors J.M. et al. ABVD Alone versus Radiation-Based Therapy in Limited-Stage Hodgkin’s Lymphoma. New England Journal of Medicine. 2012;366:399-408.
- Nogova L., Reineke T., Brillant C. et al. Lymphocyte-predominant and classical Hodgkin’s lymphoma: a comprehensive analysis from the German Hodgkin Study Group. Journal of Clinical Oncology. 2008;26:434-439.
Источник


