Цитохимический анализ крови при лейкозе

Морфология и цитохимия острых лейкозов — цитохимические реакции
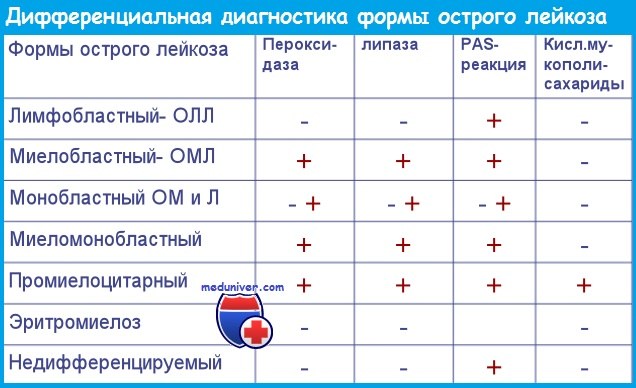
Бласты при остром миелобластном лейкозе обычно крупные клетки с округлым или неправильной формы ядром. Патогномоничным морфологическим маркером острого миелобластного лейкоза является обнаружение в цитоплазме бластных клеток гранул или линейной азурофильной зернистости (палочек Ауэра).
Большинство форм острого миелобластного лейкоза, в отличие от острого лимфобластного лейкоза, может быть идентифицировано морфологически. Миелобласты делятся на типы в зависимости от числа и качества гранул (в бластах I типа нет гранул; бласты II типа содержат до 15 нежных гранул; в бластах III типа — множество азурофильных гранул).
Лимфобласты обычно мелкие, ядро более правильной формы, цитоплазма скудная и агранулярная.
Сущность цитохимических исследований заключается в выявлении в клетке ферментов и цитоплазматических включений, характерных для того или иного типа клетки. В процессе цитохимической реакции происходит взаимодействие находящегося в клетке фермента или иного вещества с реагентами рабочего раствора.
Основные цитохимические реакции, использующиеся для диагностики и дифференциальной диагностики острого лейкоза:
1) наиболее важно выявление миелопероксидазы (фермента азурофильных гранул клеток гранулоцитарного и моноцитарного рядов); эта реакция может быть положительной при отсутствии видимых гранул;
2) вторым по значимости является судан черный В; если одна из двух реакций положительна более чем в 3% бластов, это свидетельствует об их принадлежности к миелоидной линии;
3) неспецифическая эстераза типична для моноцитов и монобластов, но может выявляться при остром лимфобластном лейкозе и МЗ; эти реакции чувствительны к ингибированию фторидом натрия, что используется для дифференциальной диагностики;
4) положительная PAS-реакция свидетельствует о наличии в клетках гликогена и наиболее типична для острого эритромиелоза; гликоген выявляется также при остром лимфобластном лейкозе и других типах острого миелобластного лейкоза
5) нафтол AS-D хлорацетатэстераза обнаруживается в созревающих миелоидных клетках;
6) кислая фосфатаза выявляется при Т-ОЛЛ;
7) а-нафтолбутиратэстераза свидетельствует о моноцитарной дифференцировке клеток.
Для верификации варианта острого лейкоза используются и другие методы. Так, для диагностики М4 и М5 вариантов острого миелобластного лейкоза используется цитобактериальный тест на лизоцим.
— Также рекомендуем «Иммунофенотипирование острых лейкозов — цели, задачи»
Оглавление темы «Острые лейкозы»:
- Острые лейкозы — история изучения, причины
- Механизмы развития острого лейкоза — патогенез
- Клиника острого лейкоза — симптомы
- Лабораторная диагностика острого лейкоза — анализы
- Дифференциальная диагностика острого лейкоза
- Классификация острых лейкозов
- Морфология и цитохимия острых лейкозов — цитохимические реакции
- Иммунофенотипирование острых лейкозов — цели, задачи
- Цитогенетические исследования при остром лейкозе — кариотипы
- Принципы химиотерапии острых лейкозов — основы лечения
Источник
Лекция.
(Ст. Преподаватель Свирина В.И.)
В дифференциальной диагностике гемобластозов цитохимические исследования занимают важное место. Помимо глубокого теоретического значения, неоспорима их роль в уточнении различных форм лейкозов. Разработка эффективных методов дифференцированной терапии острых лейкозов, особенно острого лимфобластного лейкоза детей, стала возможной только после применения в клинической практике цитохимических методов диагностики.
Ниже представлено краткое описание некоторых цитохимических методик. Они ограничены исследованиями, используемыми для идентификации различных форм острых лейкозов. К ним относятся реакции: на миелопероксидазу, полисахариды, хлорацетатэстеразу, альфа-ацетатнафтилэстеразу, кислую фосфатазу, липиды и кислые сульфатированные мукополисахариды.
Реакция на пероксидазу.Пероксидаза является ферментом, разрушающим перекись водорода, образующуюся в клетке в процессе жизнедеятельности. Токсичная для клеток перекись водорода обезвреживается, освобождающийся при участии пероксидазы кислород вновь используется клеткой.
Пероксидаза обнаруживается не во всех клетках, этот фермент отсутствует в лимфоидных клетках и постоянен для всех элементов миелоидного ряда. Ввиду его специфичности для нейтрофилов с ранних фаз созревания фермент получил обозначение миелопероксидазы. Уровень активности пероксидазы подвержен большим колебаниям.
Рис. 1. Положительная реакция на миелопероксидазу в клетках миелоидного ряда.
Х о д р е а к ц и и. Фиксированные мазки крови или костного мозга заливают бесцветным раствором бензидина или ортотолидина.
К раствору, перед тем как его наливают на мазок, добавляют каплю 3% перекиси водорода. Если в клетке содержится пероксидаза, то перекись водорода превращается в воду с выделением кислорода. Высвободившийся кислород окисляет бензидин или ортотолидин и переводит их в окрашенное соединение. При использовании бензидина цитоплазма клеток, содержащих пероксидазу, окрашивается в желтый цвет.
Все клеточные элементы нейтрофильного ряда костного мозга, начиная с ранних фаз созревания, дают резко положительную реакцию. В препарате цитоплазма клеток окрашена в желтый цвет.
Цитохимическая реакция на полисахариды (гликоген). Энергетические потребности клетки обеспечиваются гликогеном. Сложные метаболические процессы, связанные с расщеплением и ресинтезом гликогена под воздействием различных патологических процессов, могут извращаться. При цитохимическом анализе используется определение этих отклонений. Для обнаружения гликогена в клетках применяется ШИК – реакция.
Х о д р е а к ц и и. Под воздействием реактива Шиффа, в состав которого входит фуксин, появление в цитоплазме клеток красных или фиолетово-красных зерен указывает на присутствие полисахаридов (гликогена). После проведения ШИК – реакции и докраски гематоксилином все клеточные элементы хорошо дифференцируются. Ядра нейтрофилов окрашиваются в синий цвет, цитоплазма заполняется мелкой красной зернистостью гликогена, как бы сплошной окраской. Существует различная степень окраски цитоплазмы.
Рис. 2. Положительная реакция на гликоген в гранулоцитах (диффузное окрашивание цитоплазмы)
Моноциты содержат гликоген, выявляемый в виде мелких пылевидных красных гранул на фоне неокрашенной или розоватой цитоплазмы. В эозинофилах при ШИК – реакции неокрашивающихся из-за обилия эозинофильной зернистости, судить о содержании гликогена невозможно. Определение ШИК – реакции в эозинофилах, так же как в базофилах, практического значения не имеет. Наиболее ценно ее значение для исследования зрелых нейтрофилов и лимфоцитов.
В лимфоцитах гликоген определяется в виде сравнительно крупных красных, не сливающихся между собой, зерен. Количество их находится в зависимости от ширины пояса, образованного цитоплазмой вокруг ядра. Для уточнения характера малых лимфоцитов с тонким ободком цитоплазмы необходимо внимательное изучение препарата под микроскопом. Только наличие крупных, хотя и единичных, красных зерен указывает на положительную ШИК – реакцию лимфоцитов.
Рис. 3. Положительная реакция на гликоген в лимфоцитах (в виде гранул вокруг ядра)
Хлорацетатэстераза.Хлорацетатэстераза относится к неспецифическим эстеразам и наряду с реакцией на миелопероксидазу является биохимическим маркером клеток нейтрофильного ряда. Активность хлорацетатэстеразы, выявляемая в миелобластах, возрастает у промиелоцитов и миелоцитов. Активность фермента при остром миеломонобластном лейкозе низкая, а при остром монобластном лейкозе она совсем не обнаруживается.
Положительная реакция на хлорацетатэстеразу с использованием метода Яма позволила наряду с реакцией на миелопероксидазу дифференцировать по бластным клеткам острый миелобластный лейкоз. Положительная реакция определяется по мелкой синей зернистости, выпадающей в цитоплазме клеток.
Рис. 4. Положительная реакция на хлорацетатэстеразу в миелобастах и созревающих гранулоцитах
Альфа — ацетатнафтилэстераза (неспецифическая эстераза). Этот фермент также содержится в клетках нейтрофильного ряда, начиная с миелобласта. Реакция на альфа-ацетатнафтилэстеразу особенно ярко выражена у клеток моноцитарного ряда и их молодых форм. Она приобретает важное диагностическое значение при остром монобластном лейкозе. Характерна следующая важная отличительная особенность: при остром монобластном лейкозе неспецифическая эстераза подавляется фтористым натрием в концентрации среды 1,5 мг/мл. Этот признак позволяет отличить клетки монобластного ряда от клеток других ростков, также обладающих активностью неспецифической эстеразы. При положительной реакции на альфа — ацетатнафтилэстеразу цитоплазма клеток заполнена мелкой темно-бурой зернистостью.
Рис. 5. Положительная реакция на альфа-нафтил-ацетатэстеразу в миелобластах и созревающих гранулоцитах
Щелочная и кислая фосфатаза.Активность фосфатаз в нейтрофилах выявляется гистохимическим методом Гомори и методом азосочетания. Активность щ е л о ч н о й ф о с ф а т а з ы характерна для зрелых форм нейтрофилов, при различных заболеваниях она подвержена закономерным изменениям. В частности, для хронического миелолейкоза характерно резкое снижение щелочной фосфатазы, что является важным диагностическим признаком.
К и с л а я ф о с ф а т а з а в клетках связана с процессами клеточной дифференцировки. В клетках миелоидного ряда она выявляется уже в молодых предстадиях нейтрофилов, по мере вызревания клеток этого ряда ее активность снижается. Зрелые нейтрофилы лишены этой активности. Положительная реакция на кислую фосфатазу отмечается при остром миелобластном лейкозе. Резко положительна эта реакция при остром монобластном лейкозе.
Рис. 6. Положительная реакция на кислую фосфатазу в миелобластах и созревающих гранулоцитах
Реакция на липиды. Липиды содержатся в клетках различных тканей. Клетки костного мозга и периферической крови содержат так называемые простые липиды в виде нейтральных жиров, свободных жирных кислот и др., а также сложных липидов — фосфолипидов. Особенно много их обнаруживают в зрелых нейтрофилах. Для выявления липидов в клетках крови применяют окраску суданом черным Б. В клетках лимфатического ряда липиды не выявляются. В клетках нейтрофильного ряда липиды могут быть определены уже в бластных элементах и по мере созревания клеток этого ряда количество суданофильных веществ в гранулоцитах увеличивается. Моноциты также содержат липиды, но в меньшем количестве, чем нейтрофилы.
Рис. 7. Положительная реакция на липиды в гранулоцитах
Реакция на кислые мукополисахариды. Зернистость клеток гранулоцитарного ростка содержит кислые мукополисахариды; основным компонентом последних является хондроитин — 4 — сульфат. Наибольшее количество кислых мукополисахаридов синтезируют незрелые клетки зернистого ряда.
Реакция на сульфатированные кислые мукополисахариды специфична при промиелоцитарном остром лейкозе и характеризуется появлением в цитоплазме богатой сравнительно крупной розово-вишневой зернистости. Ядра клеток окрашиваются в светлый серо-голубой цвет.
Рис. 8. Положительная реакция на мукополисахариды в созревающих гранулоцитах
Источник
Цитохимические исследования занимают важное место в дифференциальной диагностике гемобластозов. Кроме большого теоретического значения, неоспорима их роль в уточнении различных форм лейкозов. Разработка эффективных методов дифференциальной диагностики и терапии острых лейкозов, особенно острого лимфобластного лейкоза детей, стала возможной только после введения в клиническую практику цитохимических методов диагностики.
Цитохимические исследования проводят в мазках крови, лейкоконцентрата, костного мозга. Они основаны на использовании специфических химических цветовых реакций для определения в клетках различных веществ. При цитохимическом исследовании пользуются полуколичественной оценкой результатов, используя принцип G. Astaldi (1957), основанный на выявлении специфической окраски различной степени интенсивности. В зависимости от нее исследуемые элементы делят на четыре группы: с отрицательной реакцией (—), слабоположительной (+), положительной (++) и резкоположительной (+++).
Для количественного выражения результатов подсчитывают 100 клеток определенного вида и дифференцируют их по указанному принципу, затем число клеток с одинаковой интенсивностью окраски умножают на соответствующее данной группе число плюсов, сумма этих произведений составляет условные единицы (ед.). Активность ферментов выражают в условных единицах или в виде среднего цитохимического коэффициента (СЦК). Средний цитохимический коэффициент вычисляют по формуле Кеплоу в модификации Астальди и Верга:
![]()
где цифры (1, 2, 3, 4) обозначают интенсивность окраски; буквы (а, б, в, г) — число подсчитанных клеток с определенной интенсивностью окраски (цитохимической реакции).
Метод полуколичественной оценки является ориентировочным, но позволяет сравнить распределение исследуемых веществ в различных клеточных элементах или в одних и тех же клетках при тех или иных патологических состояниях. Следует, однако, иметь в виду, что цитохимический метод может использоваться только в качестве дополнения к другим методам исследования — морфологическим, иммунологическим, цитогенетическим.
Гликоген
За счет гликогена в основном обеспечиваются энергетические потребности клеток. В частности, за счет реакций гликогенолиза образуется энергия, необходимая для осуществления функции фагоцитоза. Локализуется гликоген в цитоплазме клеток. Для цитохимического выявления гликогена чаще всего применяют PAS-реакцию, или ШИК-реакцию (по названию реактива — шифф-йодная кислота).
См: Методика Шабадаша
Положительную ШИК-реакцию могут также давать такие вещества, как гликозаминогликаны, мукополисахариды, гликопротеины, мукопротеи-ны и др. Гликоген можно легко дифференцировать от других веществ пробами со слюной или α-амилазой.
Проба со слюной. Препарат помещают в свежесобранной слюне в термостат при 37 °С на 30 мин, затем его окрашивают вышеописанной методикой. При инкубации препарата αамилаза, содержащаяся в слюне, расщепляет гликоген, и при реакции с реактивом Шиффа розовая окраска на гликоген не развивается’.
Проба с α-амилазой. Препарат помещают в раствор α-амилазы (1 мл профильтрованной амилазы растворяют в 40 мл 0,85% раствора натрия хлорида) на 30 мин в термостат при 37 °С.
Нормальные величины. В мазках периферической крови и костного мозга гликоген содержится в цитоплазме нейтрофилов разной степени зрелости, но преимущественно в более зрелых (в виде обильной мелкой и диффузной зернистости). В цитоплазме мегакариоцитов и тромбоцитов гликоген определяется в виде одиночных крупных зерен. В крови здоровых людей количество интенсивно окрашенных нейтрофилов (+++) колеблется в пределах 2–12 % от общего числа нейтрофилов, средней интенсивности окраски (++) — в пределах 72–90%, слабо окрашенных (+) — от 4 до 18%. СЦК гликогена в нейтрофилах здоровых людей равен 1,71–2,04 (Кост Е. А., 1975), а по данным В. Б. Лецкого (1970) — 2,52. У лиц пожилого и старческого возраста отмечено достоверное снижение СЦК гликогена до 1,98 (Германов В. А., Сергеева Т. М., 1972).
В лимфоцитах здоровых людей гликоген содержится в виде небольшого числа гранул в 10–12% клеток. В мегакариоцитах гликоген обнаруживается в виде гранул (от единичных до 30–50), напоминая скопления кровяных пластинок. Число гликогенположительных мегакариоцитов составляет в среднем 60 % от общего числа мегакариоцитов.
Клиническое значение. Увеличение числа гликогенположительных лимфоцитов4 (до 70–80 %) характерно для лимфопролиферативных заболеваний, особенно для хронического лимфолейкоза (гликоген определяется в виде крупных гранул). Увеличение содержания гликогена в нейтрофилах наблюдается при различных воспалительных процессах, сахарном диабете, истинной полицитемии. Уменьшение отмечается при агранулоцитозах, лучевой болезни, при хроническом миелолейкозе — примерно в 2 раза по сравнению с нормой, особенно при прогрессировании заболевания (общее количество гликогена, определяемое биохимическими методами, может быть даже повышено из-за лейкоцитоза). При тромбоцитопенической пурпуре и симптоматических тромбоцитопениях число гликогенположительных форм мегакариоцитов значительно снижено (после спленэктомии оно восстанавливается до нормальных величин).
В лейкемических клетках при остром миелобластном лейкозе гликоген или не содержится вообще, или распределен диффузно либо в виде мелкой зернистости; при остром лимфобластном лейкозе — в виде крупных гранул, расположенных в цитоплазме вокруг ядра; при остром монобластном лейкозе бластные клетки содержат незначительное количество диффузно окрашиваемого гликогена; при остром эритромиелозе гликоген в виде гранул обнаруживается в эритробластах.
Липиды
Липиды локализуются в цитоплазме клеток, главным образом, в мембранах органелл и обнаруживаются преимущественно в нейтрофильных гранулоцитах. Играют важную роль в проницаемости мембран. Клетки костного мозга и периферической крови содержат простые липиды в виде нейтральных жиров, свободных жирных кислот, а также сложные липиды — фосфолипиды. Цитохимическое исследование основано на применении веществ, растворяющихся в жирах (судан III, судан IV, черный судан и др.). Для выявления нейтрального жира применяют судан III, окрашивающий жир в оранжевый цвет. Липоиды лучше выявляются Суданом черным (черное окрашивание). В гематологических исследованиях чаще применяется окраска мазков Суданом III.
См. методики окраски:
- Окраска суданом III (методика Гольдмана)
- Окраска суданом черным
Нормальные величины. Липиды содержатся в цитоплазме нейтрофилов в виде обильной зернистости. Большинство нейтрофилов (69–80 %) у здоровых людей окрашивается интенсивно (+++), 18–36 % — дают окраску средней интенсивности (++) и 10 % — слабо окрашены (+). СЦК липидов в нейтрофилах здоровых людей равен 2,65. В меньших количествах липиды в норме обнаруживаются и в моноцитах. В миелобластах обнаружено небольшое количество липидов, в промиелоцитах их больше, и по мере созревания нейтрофилов содержание липидов увеличивается. В клетках лимфатического ряда липиды не выявляются.
Клиническое значение. Повышение СЦК липидов отмечено у лиц старческого возраста. Повышение содержания липидов в нейтрофилах наблюдается при остром миелобластном и монобластном лейкозах, при прогрессировании хронического миелолейкоза. При недифференцированном остром лейкозе бластные клетки содержат липиды в небольшом количестве (2–3 %). Уменьшение СЦК липидов отмечено при лечебном голодании. Снижение содержания липидов в нейтрофилах выявлено при ревматизме, воспалительных процессах. При остром лимфобластном лейкозе липиды в бластных клетках не выявлены.
Пероксидаза (миелопероксидаза)
В организме человека пероксидаза обнаружена в лейкоцитах, тромбоцитах, в молоке, а также в тканях, в которых происходит метаболизм эйкозано-идов. Простетической группой является протогем. В реакции, катализируемой пероксидазой, перекись водорода восстанавливается за счет соединений, выступающих в качестве доноров электронов, таких как аскорбат, хиноны или цитохром С. Реакция, катализируемая пероксидазой, имеет сложный характер и суммарно выглядит следующим образом:
![]()
Пероксидаза локализуется преимущественно в специфической зернистости цитоплазмы гранулоцитов, является маркером клеток миелоидной природы. Она отсутствует в лимфоидных клетках. Ввиду специфичности для нейтрофилов, начиная с ранних фаз созревания, фермент получил название миелопероксидаза. Активность пероксидазы подвержена большим колебаниям.
См. методики окраски:
- Методика Грэхема—Кнолля
- Методика Кеплоу
- Модифицированная методика Р. П. Нарциссова
Нормальные величины. В крови здоровых людей активность пероксидазы выявляется преимущественно в цитоплазме гранулоцитов, в меньшей степени и непостоянно — моноцитов. Фермент появляется в клетках на стадиях промиелоцита и более зрелых миелобластов. Лимфобласты не содержат пероксидазу. 3–16% нейтрофилов окрашены резко положительно (+++), 60–90 % — положительно (++), остальные — слабоположительно (+) (Кост Е. А., 1975). СЦК пероксидазы в нейтрофилах здоровых людей равен 2,5 (Лецкий В. Б., 1970). Эозинофилы характеризуются резко положительной реакцией на пероксидазу.
Клиническое значение. В бластных клетках высока активность фермента при остром миелобластном лейкозе. У больных с хроническим миелолейкозом, особенно в терминальной стадии, СЦК снижается до 1,6; слабая активность фермента наблюдается при остром монобластном лейкозе и отсутствует при остром лимфобластном лейкозе. Определение активности миелопероксидазы как маркера миелоидного ряда используется для дифференциальной диагностики острых миелобластных и лимфобластных лейкозов. Снижение активности фермента отмечено при инфаркте миокарда, ревматизме, туберкулезе, опухолях.
Щелочная фосфатаза
Активность щелочной фосфатазы выявляется впервые на стадии метамиелоцита, повышается по мере дифференцировки до сегментоядерного нейтрофила, а затем по мере старения клетки вновь снижается. Активность фермента определяется в специфических гранулах цитоплазмы. Щелочная фосфатаза относится к группе гидролитических ферментов, расщепляет различные фосфорные эфиры в щелочной среде (оптимум pH 9,6), осуществляет гидролиз однозамегценных эфиров ортофосфата. Наиболее распространено определение активности фермента методами азосочетания.
См. методики окраски:
- Методика Кеплоу (Карlow L.)
- Методика азосочетания в модификации М. Г. Шубича
Нормальные величины. У здоровых людей большинство сегментоядерных нейтрофилов являются фосфатазоотрицательными, и только в 20–30 % клеток (Кост Е. А., 1975) (20–40% — по данным Л. В. Козловской и М. А. Мартыновой, 1975) выявлена слабая активность фермента (+). По данным М. Г. Шубина (1980), активность щелочной фосфатазы для здоровых лиц обоего пола составляет 26 ед., т. е. СЦК равен 0,26. Отмечена более высокая активность фермента у женщин по сравнению с мужчинами (соответственно 31,0±0,8 и 21,0±0,7 ед.).
Клиническое значение. Повышение активности фермента в цитоплазме нейтрофилов отмечается при истинной полицитемии, хроническом миелофиброзе, апластических анемиях. Увеличение активности щелочной фосфатазы в цитоплазме нейтрофилов при острых нелимфобластных лейкозах — благоприятный признак, поскольку у таких больных более вероятны ремиссии. Увеличение активности фермента выявлено у детей первого полугодия жизни— 150–159 ед. Активность фермента увеличивается при беременности, при многих воспалительных процессах, хронических заболеваниях печени, инфекциях, злокачественных новообразованиях, диабетическом кетоацидозе, приеме пероральных контрацептивов, болезни Дауна, инфаркте миокарда и др. Резкое снижение активности щелочной фосфатазы (до полного отсутствия) наблюдается при хроническом миелолейкозе, что может служить важным дополнением дифференциальной диагностики хронического миелолейкоза и хронического миелофиброза, а также лейкемоидных реакций по миелоидному типу. Снижение активности фермента наблюдается при вирусных заболеваниях, в том числе инфекционном гепатите, при лучевой болезни, серповидно-клеточной анемии, болезнях соединительной ткани.
Кислая фосфатаза
Активность кислой фосфатазы обнаруживается преимущественно в нейтрофилах и лимфоцитах крови (максимально в нейтрофильных миелоцитах); локализацию связывают с лизосомами цитоплазмы клеток. Кислая фосфатаза является гидролитическим ферментом (оптимум действия при pH 5,2). Для цитохимического исследования обычно используют методы азосочетания. Нафтолфосфаты под воздействием кислой фосфатазы расщепляются с образованием свободного нафтола, который вступает в реакцию с солью диазония. В результате в местах определяемой активности фермента выпадает осадок азокрасителя красного цвета на зеленом фоне.
См. методики окраски:
- Методика азосочетания Берстона в модификации Ю. Ф. Руденса и И. М. Буйкиса
- Методика азосочетания
Нормальные величины. В клетках крови активность фермента обнаруживается в 12% зрелых гранулоцитов и в лимфоцитах. В нейтрофилах периферической крови здоровых людей активность фермента колеблется в пределах 11–72 ед., т. е. СЦК равен 0,386; в лимфоцитах— 25,0–28,8 ед., т. е. СЦК равен 0,286. У детей активность кислой фосфатазы в нейтрофилах выше, чем у взрослых.
Клиническое значение. Активность кислой фосфатазы повышается при острых лейкозах — монобластном и миелобластном, особенно при остром промиелоцитарном лейкозе (в диффузной форме), при острых лимфобластных лейкозах (в гранулярной форме). Повышение активности фермента наблюдается в нейтрофилах при воспалительных процессах (острая пневмония), туберкулезе, инфаркте миокарда, острых хирургических инфекциях, злокачественных опухолях. Повышение активности фермента в лимфоцитах отмечается при хронических тонзиллитах, при различных аллергических заболеваниях, после иммунизации.
Неспецифические эстеразы
Неспецифические эстеразы — это группа ферментов (гидролаз) с невысокой специфичностью, расщепляющих эфиры карбоновых кислот с короткой углеродной цепью. Локализуются в цитоплазме клеток, главным образом, в лизо-сомах. Активность этих ферментов в той или иной степени выявляется во всех видах лейкоцитов (максимально в незрелых гранулоцитах и моноцитах). Наибольшая активность обнаружена в моноцитах крови. Для определения активности ферментов используют различные субстраты (α-нафтилацетат, нафтол-AS-ацетат, нафтол-AS-D-хлорацетат и др.). Под влиянием неспецифических эстераз из субстрата освобождается свободный нафтол, который дает цветное окрашивание с солями диазония.
См.:
- α-Нафтилацетатэстераза. Методика Леффлера (Н. Loffler)
- Кислая α-нафтилацетатэстераза. Методика Кулленкампфа
- Нафтол-AS-ацетатэстераза. Методика Леффлера (Н. Loffler)
- Нафтол-AS-D-хлорацетатэстераза. Методика Молони и др. ( М. С. Moloney et. al)
Дегидрогеназы
Дегидрогеназы — ферменты, катализирующие окислительно-восстановительные реакции с участием двух субстратов. Ряд из них принимает непосредственное участие в процессах биологического окисления, осуществляя перенос протонов с субстрата, подвергающегося окислению, на другой субстрат. Дегидрогеназы, катализирующие такое восстановление, специфичны как к донору водорода, так и к его акцептору. Дегидрогеназы присутствуют в самых различных клетках и тканях. Они локализуются в цитоплазме и митохондриях, могут быть выявлены цитохимически при экспозиции клеток с соответствующим субстратом, на который дегидрогеназы действуют в присутствии тетразолиевых соединений, способных акцептировать протоны, с образованием нерастворимых окрашенных соединений.
См.:
- Сукцинатдегидрогеназа. Методика Нахласа в модификации Кваглино и Хейхо
- Сукцинатдегидрогеназа. Методика Нахласа в модификации Р. Н. Нарциссова
- α-Глицерофосфатдегидрогеназа (α-ГФДГ). Методика Нахласа в модификации Р. П. Нарциссова
Нормальные величины. У здоровых людей СДГ и α-ГФДГ выявляются в виде гранул синего цвета в нейтрофилах, лимфоцитах, тромбоцитах периферической крови и миелобластах, гранулоцитах, мегакариоцитах, эритро- и нормобластах костного мозга.
СЦК СДГ лимфоцитов составляет 1,10±0,05; α-ГФДГ — 0,80±0,08. У детей активность СДГ выявляется в 46 % лимфоцитов. У взрослых в пунктате костного мозга 88 % недифференцированных клеток имеют активность фермента (+), все ядросодержащие клетки эритроидного ряда и гранулоциты проявляют активность на (+) или (++).
Клиническое значение. Повышение активности СДГ и α-ГФДГ в гранулоцитах обнаружено у больных со злокачественными опухолями. Снижение активности выявляется в лимфоцитах в период приступа бронхиальной астмы, при хроническом лимфолейкозе, в гранулоцитах — при хроническом миелолейкозе.
Источник