Цитогенетический анализ крови что это
Современная медицина может предложить будущим родителям не только узнать пол ребенка и увидеть его черты лица, но и заранее определить, какие болезни ждут их отпрыска в будущем. Помогает в этом цитогенетическое исследование. Для его проведения достаточно нескольких миллилитров крови или любой другой жидкости/ткани плода. После проведения сложных химических и физических манипуляций с материалом врач-генетик может дать ответы на интересующие семью вопросы.
Определение

Цитогенетическое исследование – это микробиологическое исследование генетического материала человека с целью выявления генных, хромосомных или митохондриальных мутаций, а также онкологических заболеваний. Значение этого исследования определяется доступностью клеток для кариотипирования и изучения происходящих в них изменений.
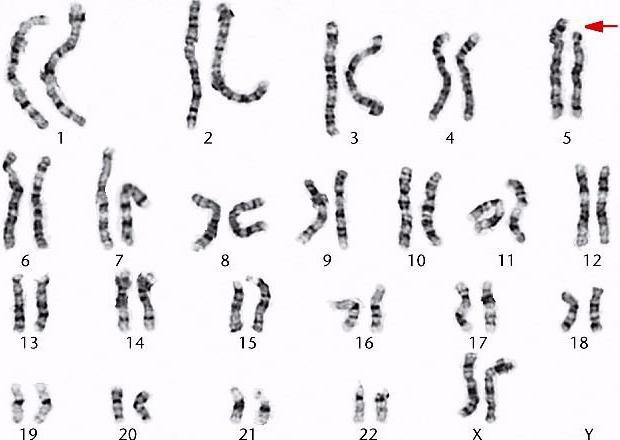
Внешний вид молекулы ДНК в ядре клетки сильно варьируется в зависимости от фазы клеточного цикла. Для того чтобы провести анализ, необходимо, чтобы произошла конъюгация хромосом, которая бывает в метафазе мейоза. При качественном заборе материала каждая хромосома видна как две отдельные хроматиды, расположенные в центре клетки. Это идеальный вариант, чтобы провести цитогенетическое исследование. Кариотип человека в норме состоит из 22 пар аутосом и двух половых хромосом. У женщин это ХХ, а у мужчин — ХУ.
Показания
Цитологическое исследование проводится при наличии конкретных показаний как со стороны родителей, так и со стороны ребенка:
— мужское бесплодие;
— первичная аменорея;
— привычное невынашивание беременности;
— мертворождение в анамнезе;
— наличие детей с хромосомными аномалиями;
— наличие детей с пороками развития;
— перед процедурой экстракорпорального оплодотворения (ЭКО);
— наличие в анамнезе неудачных ЭКО.
Для плода существуют отдельные показания:
— наличие у родившегося ребенка пороков развития;
— умственная отсталость;
— задержка психомоторного развития;
— аномалии пола.
Исследование крови и костного мозга
Цитогенетическое исследование крови и костного мозга проводится для определения кариотипа, выявления количественных и качественных нарушений в структуре хромосом, а также подтверждения онкологического заболевания. Клетки крови с ядрами (лейкоциты) культивируют в питательной среде трое суток, затем фиксируют полученный материал на предметном стекле и изучают под микроскопом. На этом этапе важно качественное окрашивание зафиксированного материала и уровень подготовки врача-лаборанта, который будет осуществлять исследование.
Для анализа костного мозга необходимо получить из биоптата не менее двадцати клеток. Забор материала должен проводиться только в условиях лечебного учреждения, так как процедура болезненная, а кроме того, необходимы стерильные условия для предупреждения инфицирования места пункции.
Исследование плода

Цитогенетическое исследование плода назначается врачом-генетиком после консультации супружеской пары. Существует несколько вариантов забора материала для этого анализа. Самый ранний – это биопсия плаценты. Забор материала на цитогенетическое исследование хориона проводится трансвагинально, под контролем УЗИ. Аспирационной иглой берется несколько ворсинок будущей плаценты, которые уже содержат ДНК эмбриона. Процедуру можно проводить с 10-й недели беременности. Начиная с третьего месяца разрешается делать амниоцентез. Это аспирация околоплодных вод, где находятся клетки эпителия плода, которые можно использовать как материал для исследования.
Третий вариант – кордоцентез. Данная процедура может навредить ребенку, поэтому показания должны быть достаточно вескими. Через переднюю брюшную стенку в амниотический пузырь вводится игла, которая затем должна попасть в вену пуповины и забрать часть крови. Вся процедура проводится под УЗИ-контролем.
С помощью этих методов можно определить моногенные, хромосомные и митохондриальные патологии будущего ребенка и принять решение о продлении либо прерывании беременности.
Анализ опухолевых клеток

Молекулярно-цитогенетическое исследование хромосом раковых клеток затруднено из-за их морфологических изменений, а также плохой различимости полос. Это может быть транслокация, делеция и т. д. На современном уровне для исследования таких образцов используют гибридизацию in situ (т. е. «на месте»). Это позволяет выявить местоположение хромосом в любой молекуле ДНК или РНК. Можно таким образом искать и маркеры других заболеваний. Важно, что проводить исследования можно не только в метафазу, но и в интерфазу, что увеличивает количество материала.
Главная загвоздка состоит именно в маркерах онкологических заболеваний, так как в каждом конкретном случае необходимо приготовить индивидуальную последовательность нуклеотидов и размножить ее. Затем, после накопления достаточного количества исследуемой ДНК, проводится, собственно, гибридизация. В конце нужно отделить участки, которые были выявлены, и сделать вывод о результатах исследования.
Виды нарушения хромосом
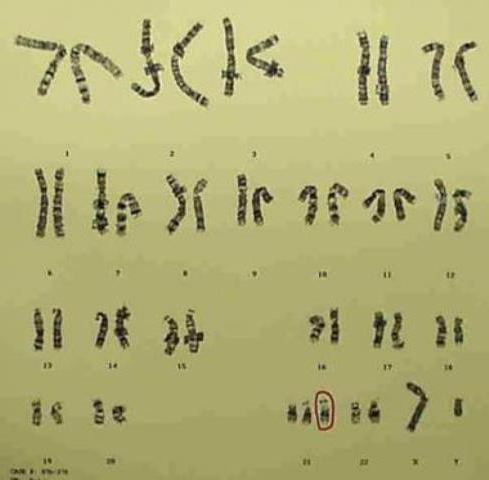
На сегодняшний день насчитывают несколько видов хромосомных нарушений:
— моносомии – наличие только одной хромосомы из пары (болезнь Шерешевского — Тернера);
— трисомии – добавление еще одной хромосомы (сидром суперженщины и супермужчины, Дауна, Патау, Эдвардса);
— делеция – удаление участка хромосомы (мозаичные формы хромосомных патологий);
— дупликация – дублирование определенного участка хромосомного плеча;
— инверсия – поворот участка хромосомы на сто восемьдесят градусов;
— транслокация – перенос участков генома с одной хромосомы на другую.
Структурные нарушения хромосом передаются следующему поколению и могут накапливаться, поэтому возрастает риск рождения больных детей. Материал цитогенетических исследований тщательно изучается на предмет наличия повреждений, и по нему делается заключение о состоянии всего организма.
Клиническое значение

Клетка, которая имеет приобретенную или врожденную аномалию, может стать предшественницей целого клана клеток, которые сформируют опухоль или стигму дисэмбриогенеза. Своевременное их обнаружение способствует ранней постановке диагноза и принятию решения о дальнейшей тактике лечения. Цитогенетическое исследование дало возможность многим супружеским парам, имеющим дефектные рецессивные гены, родить здоровых детей либо, если это невозможно, задуматься о процедуре ЭКО и суррогатном материнстве.
Источник
Цитогенетические исследования в гематологии: окрашивание хромосом, метод FISH
Цитогенетическое исследование — это микроскопический анализ хромосом, результаты которого весьма важны для постановки диагноза, классификации, лечения и научного исследования заболеваний системы крови, прежде всего — онкогематологических. Значение цитогенетических методов для диагноза и лечения определяется доступностью опухолевых клеток для кариотипирования и их гетерогенностью, а с научной точки зрения — возможностью изучения изменений в структуре и функции генетических локусов, ассоциированных со злокачественной трансформацией.
Морфология хромосом сильно варьирует во время клеточного цикла. Для микроскопического анализа хромосомы должны быть визуализированы как дискретные структуры. Наилучшим образом это достигается на стадии прометафазы митоза, когда каждая хромосома видна как две идентичные хроматиды, и особенно на стадии метафазы, когда хромосомы максимально конденсированы и располагаются в одной плоскости в центре клетки отдельно одна от другой.
Нормальные клетки человека содержат 22 пары аутосом и одну пару половых хромосом: две Х-хромосомы у женщин и по одной копии половых хромосом (X и Y) у мужчин.
Для цитогенетического анализа лейкозов, миелодиспластических синдромов и хронических миелопролиферативных заболеваний исследуют клетки костного мозга. При невозможности их получения может быть исследована кровь (если она содержит бласты). Цитогенетический анализ лимфом выполняется в клетках ткани лимфатического узла. Культивирование клеток из опухоли повышает митотический индекс (пропорцию клеток, находящихся в фазе митоза) и способствует пролиферации злокачественных клеток.
Сравнительное кариотипирование нормальных клеток проводят в Т-лимфоцитах периферической крови, которые предварительно культивируют в среде с митогеном растительного происхождения — фитогемагглютинином.
Окрашивание хромосом в гематологии
В конце 1960-х годов была разработана методология дифференциального окрашивания метафазных хромосом, а в 1971 г. создана номенклатура хромосомных сегментов, позволяющая точно описывать хромосомные аномалии. Позднее были внедрены методики окрашивания менее конденсированных и, соответственно, более длинных профазных и прометафазных хромосом, которые обладают более высоким разрешением, так как позволяют визуализацию 500-2000 сегментов (метафазное окрашивание визуализирует только 300 сегментов).
Достаточно большое количество профазных и прометафазных клеток для анализа получают путем синхронизации клеточного цикла, культивируя клетки в среде, содержащей антиметаболит (например, метотрексат), который ингибирует синтез ДНК. Подавление синтеза ДНК останавливает клеточный цикл в интерфазе. Затем клетки переносят в среду без метотрексата, обогащенную тимидином, где они одновременно входят в фазу митоза. Обработка клеточной культуры колхицином останавливает митоз одновременно во всех клетках на стадии профазы или прометафазы.
Первая стойкая хромосомная аномалия при злокачественной опухоли человека была выявлена в 1960 г. у больных хроническим миелолейкозом и получила название филадельфийской хромосомы (Ph), по имени города, в котором было сделано это открытие. Применение технологии хромосомного окрашивания позволило выявить множество хромосомных аномалий, большая часть которых встречается при онкогематологических заболеваниях. Некоторые красители окрашивают различные участки хромосом с вариабельной интенсивностью в зависимости от структуры хроматина в этих участках, их нуклеотидного и белкового состава.
В результате такого окрашивания получают уникальный паттерн чередования светлых и темных поперечных полос, специфичный для каждой хромосомы.
В настоящее время существуют несколько видов дифференциального окрашивания хромосом. При Q-окрашивании акрихин-ипритом (quinacrine) или акрихиндигидрохлоридом выявляется особый тип флюоресценции каждой хромосомы с образованием Q-исчерченности (Q-banding) — поперечных флюоресцентных полос, называемых Q-полосами (Q.-bands). Это позволяет идентифицировать отдельные хромосомы. Анализ Q-полос выполняют с помощью флюоресцентного микроскопа.
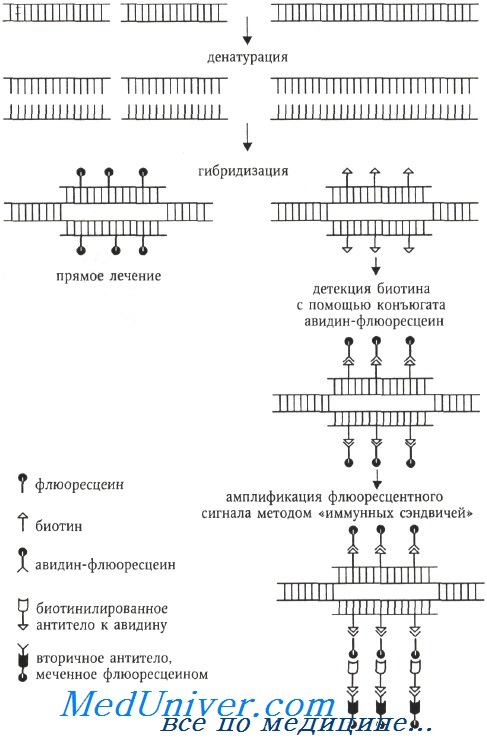
Схема анализа ДНК методом FISH
При окрашивании по Гимзе (G-banding) хромосомы приобретают вид серии темных и светлых полос или бэндов (bands). G-окрашивание применяется чаще, чем Q-окрашивание, так как анализ выполняется с помощью светового микроскопа, а G-полосы, в отличие от Q-полос, не выцветают со временем. Наиболее широко применяется методика, называемая GTG-окрашиванием (G bands by trypsin using Giemsa), с предварительной обработкой трипсином.
R-бэндинг (обработка хромосом горячим спиртовым раствором перед окрашиванием по Гимзе) выявляет полосы, которые обратны G-полосам и называются R-полосами (reverse of G bands).
Помимо Q-, G- и R-окрашивания, позволяющих выявлять полосы вдоль всей длины хромосомы, существуют методики, специализированные для исследования отдельных хромосомных структур, в том числе конститутивного гетерохроматина (С-окрашивание — от англ. constitutive), теломерного района (Т-окрашивание) и района ядрышкового организатора (NOR-окрашивание — от англ. nucleolus organizing region). Размеры и положение С-полос уникальны для каждой хромосомы, но преимущественно они включают центромерныи район и используются при исследовании хромосомных транслокаций, вовлекающих центромерные районы хромосом.
Цитогенетический анализ опухолевых клеток затруднен в связи с неясной морфологией хромосом и слабой различимостью полос. Если в исследование взяты наиболее удобные для анализа метафазные пластинки, образец может быть ошибочно охарактеризован как цитогенетически нормальный.
С развитием методов рекомбинантной ДНК стало возможным использование гибридизации in situ для определения местоположения на хромосомах или в клеточном ядре любой ДНК- и РНК-последовательности. С ее помощью можно изучать и диагностировать онкологические и наследственные генетические болезни. Молекулярная гибридизация in situ является важным инструментом цитогенетических исследований, позволяет выявлять хромосомные перестройки, идентифицировать маркерные хромосомы, проводить быстрое кариотипирование клеточных линий. Важно, что подобный анализ можно проводить не только на метафазных хромосомах, но и на интерфазных ядрах.
Разрешающая способность «интерфазной цитогенетики» на два порядка выше, чем классической цитогенетики.
Несмотря на многоцелевое использование молекулярной гибридизации ДНК-ДНК (РНК) in situ, все модификации метода выполняются в соответствии с общими принципами. Существуют несколько вариантов, которые включают в себя несколько этапов: подготовка и мечение ДНК (РНК)-зонда, приготовление препаратов хромосом, собственно гибридизация, детекция гибридных молекул.
В 1980-х годах цитогенетическая методология обогатилась молекулярно-цитогенетическим методом, называемым флюоресцентной гибридизацией in situ (fluorescence in situ hybridization, FISH), который вскоре стал наиболее популярным. Суть этого метода заключается в гибридизации ДНК-зондов к специфическим последовательностям ДНК, меченных флюорохромами, с метафазными или интерфазными хромосомами, которые визуализируются флюоресцентной микроскопией. Определение нуклеотидной последовательности методом FISH выполняется непрямым способом, путем гибридизации синтетического олигонуклеотида (зонда) с анализируемой ДНК (называемой также матричной ДНК или ДНК-мишенью).
Если зонд синтезирован с включением флюоресцентных или антигенных молекул, которые распознаются флюоресцирующими антителами, становится возможной визуализация относительного положения зонда на анализируемой ДНК.
Флюорохром может быть связан с ДНК ковалентно (прямое мечение) или посредством иммуноцитохимических реакций, когда ДНК-зонд метят гаптеном (биотин, дигоксигенин), а флюорохром связан с алкалоидом авидином (стрептавидином), обладающим сильным сродством к биотину (или с антителами против биотина или дигоксигенина). При использовании гаптенов возможна амплификация флюоресцентного сигнала с помощью биотинилированных антител к авидину и вторичных антител, специфичных предыдущему слою антител и окрашенных флюорохромом.
Для амплификации флюоресцентного сигнала применяется метод «иммунных сэндвичей». Например, на препарат, изображенный на схеме, наносят биотинилированные антитела к авидину, а затем снова комплекс авидин-флюоресцеин. При необходимости цикл может быть повторен. Антитела в свою очередь выявляются с помощью ферментативного (например, авидинпероксидазы) или флюоресцентного детектора.
Метод FISH предназначен для выявления:
1) гибридных клеток;
2) транслокаций и других, в том числе числовых, хромосомных аномалий;
3) меченых хромосом в интерфазных и метафазных клетках.
Высококонтрастная флюоресцентная гибридизация достигается благодаря использованию флюоресцентных красителей разного цвета. С помощью двуцветной FISH выявляются тонкие структурные аномалии, например хромосомные транслокации, в том числе и неразличимые при дифференциальном окрашивании.
В настоящее время возможно выполнение многоцветной гибридизации in situ для одновременного окрашивания всех хромосом в сложном кариотипе с множественными числовыми и структурными аномалиями. Комбинация разных модифицирующих агентов и флюорохромных красителей позволяет одновременно выявлять несколько последовательностей ДНК в одном ядре (флюоресцеин дает зеленую флюоресценцию, техасский красный и родамин — красную, гидроксикумарин — голубую и т. д.). Сочетание пяти флюорохромов в разных пропорциях и компьютерный анализ изображений позволяет одновременно окрасить разным цветом все хромосомы и визуализировать 27 различных ДНК-зондов, которые служат уникальной меткой для каждой хромосомы. Эта методика называется многоцветной FISH (multicolor, или multiplex, fluorescence in situ hybridization, M-FISH).
Значение цитогенетических методов неодинаково при разных онкогематологических заболеваниях. Миелоидные клетки обычно легко кариотипируются при дифференциальном окрашивании, и FISH лишь подтверждает результаты рутинной цитогенетики. Лимфоидные клетки у больных хроническим лимфолейкозом и, особенно, множественной миеломой кариотипировать значительно сложнее из-за низкого уровня пролиферации (даже при использовании В-клеточных митогенов). В этом случае FISH демонстрирует в несколько раз большую частоту анеуплоидии, чем обычные цитогенетические методики.
Клиническое значение цитогенетических исследований
Диагноз. Потомство клетки с приобретенной цитогенетической аномалией может иметь пролиферативное преимущество и давать начало клону — клеточной популяции, происходящей от одной клетки-предшественницы. Обнаружение клональных хромосомных аномалий способствует постановке диагноза клонального поражения костного мозга. Например, цитогенетический анализ позволяет установить диагноз миелодиспластического синдрома у пациентов с умеренной цитопенией или при наличии в аспирате костного мозга минимально выраженных качественных нарушений гемопоэза.
Присутствие специфических хромосомных аномалий помогает выделить подгруппы пациентов, которым требуется специфическая терапия. Например, транслокация t(15;17)(q22;qll-21) подтверждает диагноз острого промиелоцитарного лейкоза (ОМЛ — МЗ), в комплексном лечении которого используется ретиноевая кислота.
Прогноз. Результаты цитогенетического анализа имеют не только диагностическое, но и прогностическое значение. Например, обнаружение множественных хромосомных аномалий у больных острыми лейкозами до начала лечения является прогностически неблагоприятным и служит основанием для выполнения трансплантации костного мозга или стволовых клеток периферической крови в первой полной ремиссии.
Контроль результатов лечения. Цитогенетический анализ костного мозга пациентов после проведенного лечения помогает контролировать степень элиминации опухолевого клона и, следовательно, полноту ремиссии. Выявление хромосомных аномалий, характерных для опухолевых клеток данного пациента, является ранним признаком, свидетельствующим о приближающемся рецидиве.
Цитогенетический анализ имеет большое значение в диагностике и лечении гематологических заболеваний, которое все возрастает по мере совершенствования методологии и накопления знаний об этиологической и патогенетической роли хромосомных аномалий в развитии этих болезней.
— Также рекомендуем «Кариотипирование в гематологии. Классификация хромосом»
Оглавление темы «Методы исследования в гематологии»:
- Уровень железа в крови норме. Исследование обмена железа
- Осмотическая резистентность эритроцитов в норме. Биохимические исследования в гематологии
- Миелограмма в норме — цитология исследования костного мозга
- Гистологические исследования в гематологии. Показания к трепанобиопсии
- Цитогенетические исследования в гематологии: окрашивание хромосом, метод FISH
- Кариотипирование в гематологии. Классификация хромосом
- Хромосомные аномалии в гематологии — классификация
- Молекулярно-генетические исследования в гематологии — возможности
- Полимеразная цепная реакция (ПЦР) в гематологии — возможности
- Методы детекции точечных мутаций в гематологии — возможности
Источник