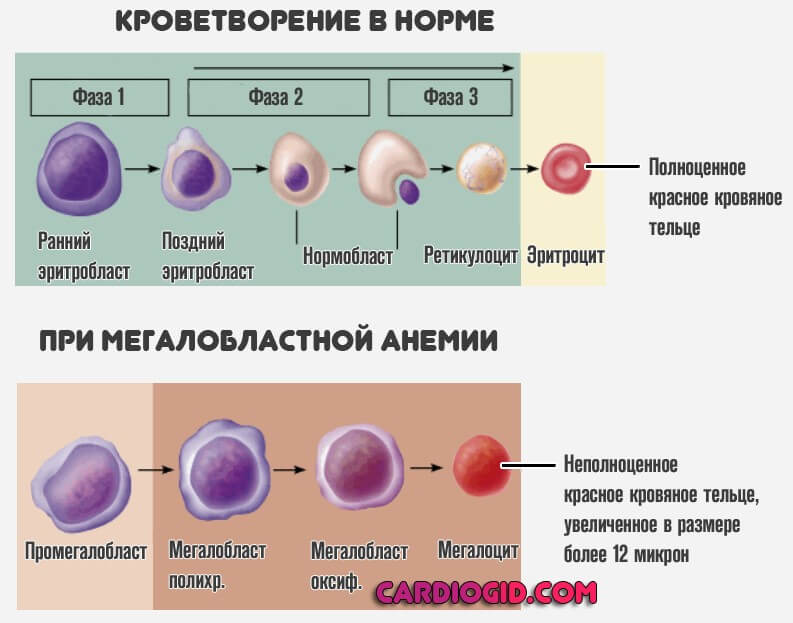
Биохимические анализы крови у кур
Биохимический профиль крови кур-несушек.
Биохимический анализ крови дает возможность ознакомиться с характером работы внутренних органов, выявить патологии в жировом, белковом, углеводном обмене. При помощи биохимического анализа крови возможно получить обширную картину состояния здоровья животного.
Гематологическое исследование крови является одним из важнейших диагностических методов, тонко отражающих реакцию кроветворных органов при воздействии на организм различных физиологических и патологических факторов. Во многих случаях оно играет большую роль в постановке диагноза, а при заболеваниях системы кроветворения ему отводится ведущая роль.
Гематологические показатели крови
эритроциты 3,0-4,0 (1012/л)
лейкоциты 20,0-40,0 (109/л)
тромбоциты 32-100 тыс
гемоглобин 80-120 г/л
цветной показатель 2-4
гематокрит 38-42%
Лейкограмма:
базофилы 1-3%
эозинофилы 6-10%
псевдоэозинофилы 24-30%
лимфоциты 52-60%
моноциты 4-10%
Физические и биохимические показатели крови птиц
Общее кол-во крови:
к весу тела 6-7%
кол-во крови на кг/веса тела 78-90мл
удельный вес крови 1,050-1,058
вязкость крови 4,5-5,5
осмотическое давление крови 0,610-0,620
рН крови 7,4-7,44
резервная щелочность плазмы крови 48-52 (об.%СО2)
плотность крови 1,044
объем крови к массе тела курица 6,0-9,0%
объем крови к массе тела петух 9,2-10,0%
Гемоглобин кур, как и большинства других птиц, представлен двумя фракциями – Нb A и Hb D. Их соотношение выражено в пропорции 3:1. Доминирующим является гемоглобин А, тогда как гемоглобин D является минорным, содержание его в норме в периферической крови не превышает 30%. Для исследования гетерогенной системы гемоглобина используется метод электрофореза в полиакриламидном геле.
Эритроциты птиц овальные, содержат ядро, которое образует двухстороннюю выпуклость.
Тромбоциты имеют форму веретена с тупыми концами. Ядро находится в центре, пикнотично и имеет слабовыраженную сетчатость.
Лейкоциты несколько меньшего размера, чем у млекопитающих.
Базофилы — клетки круглой формы, ядра имеют несколько сегментов.
Эозинофилы — круглые клетки. Ядра по форме как у базофилов.
Лимфоциты — клетки величиной 5-10 мкм, ядра круглые.
Моноциты величиной 11-15 мкм, ядро бобовидной или лопастной формы.
Относительная плотность крови у здоровых кур колеблется в следующих пределах (г/см3 или в единицах СИ, кг/л): 1,039 – 1,057; (1,050 – 1,058).
Увеличение относительной плотности крови бывает при сгущении ее (диарея, рвота, полиурия, лихорадка, непроходимость кишечника, нефрит и др.), а уменьшение — при анемиях, гемолитической желтухе, гидремии (разжижении крови вследствие обильного приема воды).
Проточная цитометрия является объективным методом количественного анализа и используется в автоматизированной диагностике патологических процессов на основе регистрации отклонений от нормы общего содержания ДНК в клетке. Проточный цитометр осуществляет распределение клеток, находящихся в различных фазах клеточного цикла.
Определение белковых фракций. Изменение белковых фракций обуславливает диспротеинемию, выражением которой является белковый коэффициент (отношение количества альбуминов к сумме глобулинов). В норме оно составляет 0,9:1,4
Алгоритм диагностики нарушений обмена веществ у лактирующих коров.
Особенности аминокислотного питания моно- и полигастричных животных
Аминокислотное питание животных — восполнение содержания аминокислот, истраченных организмом на поддержание физиол. функций, и обеспечение потребностей ж-ных в этил в-вах для образования новых тканей и продукции за счёт аминокислот корма. Из 20 аминокислот — составных частей белков корма и тканей — для моногастричных ж-ных 10 (для птиц 11) считаются незаменимыми. Они не синтезируются в организме ж-ных или синтезируются в небольшом кол-ве. При отсутствии или недостатке в корме одной или неск. незаменимых аминокислот невозможен синтез полноценных белков в организме, нарушается обмен в-в, снижаются продуктивность и плодовитость ж-ных, замедляется рост молодняка. Потребность в аминокислотах у разных видов с.-х. ж-ных неодинакова.
Если микрофлора преджелудков взрослых жвачных (рог. скот, верблюды и др.) способна синтезировать все необходимые организму аминокислоты из аммиака, выделяющегося при распаде белка или небелковых азотистых соединений (руминогепато циркуляция азота), то высокую продуктивность нежвачных ж-ных (свиньи, птица и др.), в организме к-рых аминокислоты не синтезируются, можно поддерживать, лишь сбалансировав рационы по аминокислотному составу.
Для свиней незаменимы лизин, метионин, триптофан, аргинин, гистидин, лейцин, изолейцин, фенилаланин, треонин, валин; для птиц, кроме того, — глицин. Для регулирования А. п. ж-ных необходимо знать их потребность в аминокислотах (см. Норма кормления) и аминокислотный состав кормов. Животные корма содержат все незаменимые аминокислоты, в растительных кормах нек-рых из них обычно недостаёт. Практически в рационах для свиней чаще всего не хватает лизина, иногда (кукурузные рационы) лизина и триптофана; в рационах для птиц — метионина и лизина. Молодняк по сравнению со взрослыми ж-ными больше нуждается в аминокислотах. Пром-сть выпускает для жив-ва синтетич. аминокислоты, к-рые можно использовать в качестве добавок к рационам (в точно рассчитанных дозах и в смеси с концентратами). При достаточном содержании в рационе заменимых аминокислот, а также при повышении калорийности рациона потребность в незаменимых аминокислотах уменьшается. Сбалансированные по аминокислотному составу рационы наиб. эффективны при содержании протеина в органич. в-ве в кол-ве, соответствующем потребности ж-ного. Значительно повышает использование аминокислот введение в рацион необходимого кол-ва витаминов и микроэлементов
Румино-гепато-циркуляция азота. Особенности азотистого (белкового) обмена у полигастричных. В нём принимают участии бактерии преджелудков. Они вырабатывают ферменты, которые гидролизуют белки до аминокислот, другие бактерии их дезаминируют (NH2), то есть образуется аммиак. Часть аммиака используется микробами рубца для синтеза белка своего тела, а часть поступает в печень, где аммиак превращается в мочевину. Мочевина, которая образовалась в печени, поступает в кровь , оттуда транспортируется в слюнные железы, а в качестве слюны снова поступает в рубец. Под действием уреазы мочевина распадается на аммиак и воду. А углеродный остаток аммиака становится ЛЖК.
Это используется для учёта подкормок, которые компенсируют отсутствие белка в корме. Клетчатка в рубце под влиянием целлюлозолитических ферментов доводится до глюкозы, в рубце она тут же сбраживается микробами, за счёт чего они получают много энергии, продукты их жизнедеятельности образуют ЛЖК и те всасываются в кровь. ЛЖК — уксусная кислота, пропионовая, 10% маслянная кислота.
Уксусная кислота уходит в печень и молочную железу, где включается в синтез жиров, что влияет на жирность молока. Пропионовая участвует в обмене белков
Биохимический профиль крови кур-несушек.
Биохимический анализ крови дает возможность ознакомиться с характером работы внутренних органов, выявить патологии в жировом, белковом, углеводном обмене. При помощи биохимического анализа крови возможно получить обширную картину состояния здоровья животного.
Гематологическое исследование крови является одним из важнейших диагностических методов, тонко отражающих реакцию кроветворных органов при воздействии на организм различных физиологических и патологических факторов. Во многих случаях оно играет большую роль в постановке диагноза, а при заболеваниях системы кроветворения ему отводится ведущая роль.
Гематологические показатели крови
эритроциты 3,0-4,0 (1012/л)
лейкоциты 20,0-40,0 (109/л)
тромбоциты 32-100 тыс
гемоглобин 80-120 г/л
цветной показатель 2-4
гематокрит 38-42%
Лейкограмма:
базофилы 1-3%
эозинофилы 6-10%
псевдоэозинофилы 24-30%
лимфоциты 52-60%
моноциты 4-10%
Физические и биохимические показатели крови птиц
Общее кол-во крови:
к весу тела 6-7%
кол-во крови на кг/веса тела 78-90мл
удельный вес крови 1,050-1,058
вязкость крови 4,5-5,5
осмотическое давление крови 0,610-0,620
рН крови 7,4-7,44
резервная щелочность плазмы крови 48-52 (об.%СО2)
плотность крови 1,044
объем крови к массе тела курица 6,0-9,0%
объем крови к массе тела петух 9,2-10,0%
Гемоглобин кур, как и большинства других птиц, представлен двумя фракциями – Нb A и Hb D. Их соотношение выражено в пропорции 3:1. Доминирующим является гемоглобин А, тогда как гемоглобин D является минорным, содержание его в норме в периферической крови не превышает 30%. Для исследования гетерогенной системы гемоглобина используется метод электрофореза в полиакриламидном геле.
Эритроциты птиц овальные, содержат ядро, которое образует двухстороннюю выпуклость.
Тромбоциты имеют форму веретена с тупыми концами. Ядро находится в центре, пикнотично и имеет слабовыраженную сетчатость.
Лейкоциты несколько меньшего размера, чем у млекопитающих.
Базофилы — клетки круглой формы, ядра имеют несколько сегментов.
Эозинофилы — круглые клетки. Ядра по форме как у базофилов.
Лимфоциты — клетки величиной 5-10 мкм, ядра круглые.
Моноциты величиной 11-15 мкм, ядро бобовидной или лопастной формы.
Относительная плотность крови у здоровых кур колеблется в следующих пределах (г/см3 или в единицах СИ, кг/л): 1,039 – 1,057; (1,050 – 1,058).
Увеличение относительной плотности крови бывает при сгущении ее (диарея, рвота, полиурия, лихорадка, непроходимость кишечника, нефрит и др.), а уменьшение — при анемиях, гемолитической желтухе, гидремии (разжижении крови вследствие обильного приема воды).
Проточная цитометрия является объективным методом количественного анализа и используется в автоматизированной диагностике патологических процессов на основе регистрации отклонений от нормы общего содержания ДНК в клетке. Проточный цитометр осуществляет распределение клеток, находящихся в различных фазах клеточного цикла.
Определение белковых фракций. Изменение белковых фракций обуславливает диспротеинемию, выражением которой является белковый коэффициент (отношение количества альбуминов к сумме глобулинов). В норме оно составляет 0,9:1,4
Источник
Щербина
Е.В. — Аспирант, Херсонский ДАУ
В статье
приведены данные биохимических показателей сыворотки крови исследуемого кросса
птицы в разные возрастные периоды содержания, Которые в общем плане можно
использовать как дополнительные признаки подбора для увеличения яичной
продуктивности.
Постановка
проблемы. Производительность организма в целом и отдельных его систем
определяется генотипом во взаимодействии с внешней средой. Яичная
продуктивность птицы связана с высоким уровнем обменных процессов в организме.
Процесс
подготовки к яйцекладке требует значительной перестройки всех систем организма
птицы, все эти изменения отражаются на показателях крови.
Биохимические
показатели сыворотки крови является одним из методов исследований для
определения генетической характеристики птицы в ходе проведения селекционной
работы.
Значительное
внимание уделяется изучению интерьерных показателей крови кур — несушек,
которые выращиваются в равновесных группировках, связанное с установлением
особенностей течения метаболических процессов в организме птицы и раскрытием
механизмов формирования высокого уровня производительности [1].
Состояние
изучения проблемы. В птицеводстве изучение групп крови и полиморфизм яичных
белков кур используется для получения информации о генетический потенциал кур
[2], что важно для птицефабрик, которые закупают новые зарубежные кроссы и
сохраняют резервный генофонд. Значение исследований крови заключается в том,
что она является посредником во всех процессах обмена веществ и находится в
постоянном контакте (через тканевую жидкость) со всеми органами и тканями,
отражает все внутренние процессы, происходящие меняясь как количественно, так и
качественно.
При
выведены новых пород и их дальнейшем совершенствовании, значительное внимание
уделяется изучению их генетически полиморфной системе не только в селекционном,
но и в генетическом аспекте [3].
Задачи и
методы исследований. С целью определения биохимических показателей крови кур
разных классов распределения по живой массе и длины плюсны, зависимости от
способа содержания учитывая яруса размещения был проведен эксперимент на курах
— несушках яичного кросса Иза браун, которые относятся к кроссам с коричневой
скорлупой яиц.
В поиске
тестов прогнозирования продуктивности кур большое внимание уделяют специфике
белкового обмена, от состояния которого зависит и углеводный, и жировой, и
минеральный обмены. Обмен белков лежит в основе всех жизненных процессов и
характеризует физиологическое состояние организма в целом. В процессе обмена
веществ белки крови образуют с углеводами, жирами, различными кислотами и
другими веществами различные комплексы, на последующих стадиях обмена
распадаются на свои первоначальные компоненты [4, 5,6.].
Биохимический
статус крови кур определяли по общепринятым методикам.
Экспериментальные
данные обрабатывали методом вариационной статистики с М.О.Плохинським с
использованием ПЭВМ.
Результаты
исследований. Исследование крови проводили у птицы кросса Иза браун в каждой
группе при достижении ими 28 — недельного и 72 — недельного возраста. Условия
кормления и содержания данного кросса были соответственно нормы, в ходе
исследований изучали морфологические показатели крови.
Установлено,
что 28-недельном возрасте, все показатели находились в пределах физиологических
норм для кур, но имеют определенные различия (табл. .1).
Нашими
наблюдениями установлено, что в начале яйцекладки высокий показатель общего
белка отмечается в классе М + М + — 73,14 г / л., Что на 19,7 г / л. выше в сравнении
с птицы контрольной группы. Самый низкий показатель отмечен у несушек класса
М-М— 51,97 г
/ л., Что на 1,45 г
/ л. ниже по сравнению с контрольной группы. В классе М-М + и М + М-общий белок
находился на уровне контрольной группы (53,71 г / л. И 55,47 г / л.
соответственно)
Таблица
1 Влияние класса распределения на биохимические показатели крови
исследовательской птицы в 28 недельном возрасте
Биохимические | Классы сортированной птицы | |||||
Нераспределенная птица | М -М — | М- М+ | М0 М0 | М+М- | М+ М+ | |
Общий | 53,42 | 51,97 | 53,71 | 62,16 | 55,47 | 73,14 |
Общий | 2,66 | 2,11 | 1,95 | 2,48 | 2,44 | 2,78 |
алланинаминотрансфераза | 0,37 | 0,33 | 0,32 | 0,38 | 0,45 | 0,40 |
аспартат-аминотрансфераза | 1,88 | 1,87 | 2,46 | 2,41 | 2,17 | 1,96 |
Щелочная | 4713,4 | 5107,7 | 5605,1 | 4662,1 | 4250,6 | 5616,5 |
Показатель
общего холестерина во всех классах распределения исследовательской птицы
находится почти на одном уровне.
АлАТ в
28 период выращивания имела самый высокий показатель у птицы класса М+М- и М+М+
(0,45 ммоль/(ч•л) и 0,40 ммоль/(ч•л) соответственно), что превышает показатели
птицы контрольной группы в среднем на 0,05 ммоль / (ч•л). Птица класса М-М, —
М-М+, М0М0 имеет достаточно стабильные показатели АлАт и находятся они на
уровне контрольной группы.
Высокий
показатель аспартат-аминотрансфераза отмечено в классе М-М+, М0М0 и М+М- (2,46
ммоль/(ч•л), 2,41 ммоль/(ч•л) и 2,17 ммоль/(ч•л) соответственно), что превышает
показатель контрольной группе почти на 0,5 ммоль/(ч•л). низкий показатель АсАТ
наблюдается у кур класса М-М- (1,87 ммоль/(ч•л)) по сравнению к контролю — 1,88
ммоль/(ч •л).
Неоднозначные
значения щелочной фосфатазы (ФЛ) наблюдаются птицы всех классов распределения,
но высокие показатели отмечены у птицы в классе М-М-, М-М+ и М+М+ (5107,7 Ед/л,
5605 Ед/л и 5616,5 соответственно).
В конце
продуктивного периода нашим наблюдениям были отмечены изменения в биохимических
показателях крови у несушек рассортированных на классы. По показателю общего
белка разница в сторону увеличения наблюдается в несортированных птицы на 1,45
г/л. по сравнению с начальным периодом яйценоскости, не существенные изменения
отмечено у несушек класса М-М- на 0,10 г/л. по сравнению к предыдущему периоду.
В классах М-М+; М0М0; М+М- и М+М+ увеличение произошло на 6,06 г/л; 8,97 г/л.;
6,21 г/л. и 13,63 г/л. соответственно (табл.2.)
Показатель
холестерина в 72 — недельном возрасте был несколько меньше, чем в предыдущем,
высокие показатели отмечены у птицы контрольной группы — 2,66 моль/л в классе
М+М+ — 2,78 ммоль/л. уменьшение также произошло и по показателям АлАТ у несушек
всех классов распределения в общем плане на 1,03 ммоль/(ч•л), высокие
показатели наблюдаются в классах М+М- и М+М+ (0,45 ммоль/(ч•л) и 0,40
ммоль/(ч•л) соответственно).
Таблица 2. Влияние класса распределения на
биохимические показатели крови исследовательской птицы в 72 недельном возрасте
Биохимические | Классы сортированной птицы | |||||
Нераспределенная птица | М -М — | М- М+ | М0 М0 | М+М- | М+ М+ | |
Общий | 51,97 | 51,87 | 47,65 | 53,19 | 49,26 | 59,50 |
Общий | 3,62 | 3,12 | 3,27 | 3,52 | 3,21 | 3,70 |
алланинаминотрансфераза | 0,47 | 0,49 | 0,50 | 0,52 | 0,61 | 0,54 |
аспартатаминотрансфераза | 1,52 | 1,20 | 1,17 | 2,02 | 2,03 | 1,85 |
Щелочная | 5617,8 | 4946,9 | 5598,4 | 4406,3 | 4063,3 | 4442,6 |
Аспартатаминотрансфераза
в сыворотке крови в общем плане увеличилась на 0,49 ммоль/(ч•л) по всем классам
распределения, наиболее существенное увеличение АсАТ наблюдается в классах М-М-
на 0,67 единиц и М-М+ на 1,29 единиц по сравнению с предыдущим периодом. В
классе М0М0 и у несортированной птицы увеличение произошло на одинаковое
количество единиц 0,39 ммоль/(ч•л) и 0,36 ммоль/(ч•л) соответственно, а в
классах М+М- и М+М+ — на 0,14 ммоль/(ч•л) и 0,11 ммоль/(ч•л) соответственно.
Выводы:
Во время половой зрелости и максимальной несущей птицы наблюдаются значительные
изменения метаболических процессов в организме. В результате этих изменений
было обнаружено различия биохимических показателей сыворотки крови в разные
возрастные периоды.
В общем
плане установлено, что по изученным биохимическим показателям крови,
рассортирована птица на классы несколько отличается. Установлена разница между
классами по всем биохимическими показателями крови связанная с периодом,
содержанием и уровнем производительности.
Список
литературы
1.
Мельник С.И. Птицеводство Украины в условиях аграрной реформы / С.И.Мельник,
Ю.Ф. Мельник, В.М.Семена, В.И. Бесулин // Проблемы Зооинженерный и ветеринарной
медицины. — Харьков, 2002. — Вып. 10 (34). — С.31.
2. Jean E Sander. The major histocompatibility
complex and its role in poultry production // World’s Poultry Science Journal.
— 1993. — N2 / — P/132 – 138
3. Sokal L. Principles of numerical taxonomy / L
Sokal, PHA Sneath // San Francisco and London: WH Frumona and
compani, 1963. — 362 p.
4.
Коваленко В.П. Рекомендации по использованию моделей основных селекционируемых
признаков сельскохозяйственных животных и птицы. / В.П.Коваленко, С.Ю.Болела //
Херсон, 1997. — С.32.
5.
Коваленко В.П. Применение множественного регрессионного анализа в селекции
птицы. / В.П.Коваленко / / птицеводство. — 1976. — № 21. — С.18 — 21.
6.
Прокопенко Н.П. Повышение продуктивности птицы яичных кроссов путем
усовершенствования приемов выращивания ремонтного молодняка / Н.П.Прокопенко //
Автореф. дис .. канд. с.-х. наук. — Херсон 1999. — С.11 — 12.
Источник