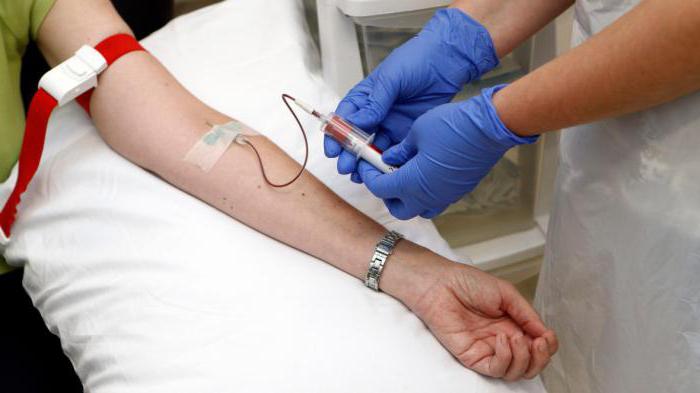
Анализ периферической крови у детей

ЛЕКЦИЯ № 14. Особенности периферической крови у детей. Общий анализ крови
1. Особенности периферической крови у детей раннего возраста
Состав периферической крови в первые дни после рождения значительно изменяется. Сразу после рождения красная кровь содержит повышенное количество гемоглобина и большое количество эритроцитов (гемоглобин 210 г/л, эритроциты 6 х 1012/л). Через несколько часов после рождения содержание эритроцитов и гемоглобина увеличивается за счет плацентарной трансфузии и гемоконцентрации, с конца первых суток начинается снижение содержания гемоглобина и эритроцитов. Кровь новорожденного отличается анизоцитозом в течение 5–7 дней, макроцитозом, диаметр эритроцитов новорожденных несколько больше, чем в более позднем возрасте. Кровь новорожденных в силу активных процессов эритропоэза содержит много незрелых форм. В первые часы жизни ретикулоцитов – предшественников эритроцитов 0,8–1,3 %, но их количество быстро снижается. Обнаруживаются ядросодержащие формы эритроцитов.
Наличие большого числа молодых незрелых эритроцитов в периферической крови в первые дни жизни свидетельствует об интенсивном эритропоэзе как реакции на недостаточность снабжения плода кислородом в период внутриутробного развития и в родах. Снижение выработки эритропоэтина в связи с установлением внешнего дыхания приводит к снижению гемоглобина и эритроцитов.
До 5-го дня жизни число лейкоцитов менее 18 х 109/л, нейтрофилы составляют 60–70 % всех клеток белой крови, лейкоцитарная формула сдвинута влево за счет большого содержания палочкоядерных лейкоцитов, могут обнаруживаться единичные миелоциты. Происходит падение числа нейтрофилов. На 5-й день жизни их число сравнивается (первый перекрест), затем количество лимфоцитов еще более возрастает (к 10-му дню до 55–60 %) на фоне снижения количества нейтрофилов. Постепенно исчезает сдвиг влево, из крови полностью исчезают миелоциты, метамиелоциты не превышают 1 % и палочкоядерные – 3 % (см. табл. 3).
Таблица 3. Гемограмма здорового ребенка
2. Лимфоидная система и иммунитет у ребенка
Лимфоидная система представлена вилочковой железой, селезенкой, лимфатическими узлами, циркулирующими лимфоцитами, скоплениями лимфоидных клеток в миндалинах, пейеровых бляшках подвздошной кишки. Вилочковая железа закладывается на 6-й неделе внутриутробного развития. Ее быстрое увеличение начинается с 14-й недели, рост продолжается в поснатальном периоде с максимальным размером в 6—12 лет и последующей инволюцией. Селезенка закладывается на 5-й неделе, к рождению не заканчивает своего полного развития, ее вес от общей массы тела составляет 0,25—0,3 %.
Функции изучены недостаточно. Селезенка является основным местом разрушения стареющих эритроцитов и тромбоцитов. В ней происходит частичный синтез иммуноглобулинов и антител. Лимфатические узлы формируются со 2-го месяца внутриутробного развития: вначале шейно-подключичные, легочные, ретроперитонеальные, паховые. Окончательное формирование (фолликулов, синусов, стромы) продолжается в постнатальном периоде. После рождения в связи с антигенной стимуляцией укрупняются зародышевые центры лимфоидных фолликулов.
На первом году недостаточно развиты капсула и трабекулы, что создает трудности при пальпации. Максимальное их количество достигается к 10 годам. У взрослых масса лимфатических узлов составляет 1 % массы тела. Функция лимфатических узлов – барьерная; бактерии, инородные тела, принесенные с током лимфы, задерживаются в синусах лимфатических узлов и захватываются макрофагами. У детей первых 2 лет жизни барьерная функция лимфатических узлов низкая, что приводит к генерализации инфекции. Первые скопления лимфоидной ткани в желудочно-кишечном тракте появляются в 3–4 месяца внутриутробного развития, к рождению количество лимфатических фолликулов невелико. Лимфоидный аппарат желудочно-кишечного тракта (ЖКТ) играет существенную роль не только в синтезе сывороточных иммуноглобулинов, но и в местном иммунитете, предохраняющем организм от инвазии инфекционных агентов.
У взрослого ежедневно синтезируется до 3 г IgA ежедневно. Недостаточное развитие лимфоидного аппарата пищеварительного тракта к рождению объясняет легкую восприимчивость детей 1-го года жизни к кишечным инфекциям, что ведет к аллергической реакции вызванной энтеральным путем.
Лимфоциты, прежде чем попасть в кровяное русло, проходят через вилочковую железу. С возрастом у детей происходит постепенное снижение содержания лимфоцитов в периферической крови. Особенно интенсивно увеличение массы лимфоцитов происходит на первом году жизни, после 6 месяцев их число остается относительно стабильно до 8 лет, затем вновь начинает возрастать. У детей раннего возраста большее число лимфоцитов имеется в лимфоидной системе вследствие антигенной стимуляции, особенно значительной в первые дни, недели и месяцы жизни.
Неспецифические механизмы играют важную роль как у плода, так и у детей первых дней и месяцев жизни. Они включают анатомические барьеры для проникновения инфекции. Это кожа с ее секреторным аппаратом и бактерицидными компонентами секрета потовых и сальных желез, барьеры слизистых оболочек с мукоцилиарным клиренсом в бронхах, моторикой кишечника и мочевыводящих путей. Содержание лизоцима (фермента, разрушающего мукополисахарид бактериальных оболочек) в сыворотке крови к рождению высокое, превышает таковой у взрослых.
Содержание пропердина, принимающего участие в альтернативном пути активации комплемента в момент рождения, низкое, быстро нарастает и держится на высоком уровне на протяжении детства. Интерфероны продуцируются клетками, первично пораженными вирусами (наиболее активно – лейкоцитами), блокируют образование РНК, необходимого для репликации вируса, усиливают фагоцитоз. Низкие дозы интерферонов способствуют антителообразованию. Способность к образованию интерферона сразу после рождения высокая, но у детей первого года жизни она снижается, с возрастом постепенно увеличивается, достигая максимума к 12–18 годам. Низкий уровень интерферона объясняет повышенную восприимчивость детей раннего возраста к вирусной инфекции.
Система комплемента состоит из двух параллельных систем: классической и альтернативной (пропердина). Активированные компоненты системы комплемента усиливают реакции фагоцитоза и лизис бактериальных. Система комплемента закладывается на 8—15-й неделе гестационного периода, но к моменту рождения общий уровень комплемента в пуповинной крови равен только половине его уровня в крови матери. В 1-ю неделю жизни он быстро нарастает и с возраста 1 месяца не отличается от уровня у взрослых.
Фагоцитоз является ранним защитным механизмом плода. Циркулирующие фагоциты – лейкоциты полиморфно-ядерные, моноциты, эозинофилы, фиксированные в тканях фагоциты – макрофаги, клетки селезенки, звездчатые ретикулоэндотелиоциты – купферовские клетки печени, альвеолярные макрофаги легких, макрофаги лимфатических желез, клетки микроглии мозга. Клетки фагоцитарной системы появляются в ранние сроки развития плода – от 6 до 12-й недели гестации. Нейтрофилы являются микрофагами, крупные мононуклеарные клетки, тканевые или циркулирующие, относятся к моноцитам.
Все время фетального периода лейкоциты обладают низкой способностью к фагоцитозу. Поглотительная способность фагоцитов у новорожденных развита достаточно, но завершающая фаза фагоцитоза формируется в более поздние сроки – через 2–6 месяцев.
Активность фагоцитоза повышается за счет опсонизации, с дефицитом компонентов системы комплемента связывают недостаточную эффективность фагоцитарной защиты у новорожденных.
Обычно дефицит фагоцитарных реакций проявляется увеличением лимфических узлов, частыми кожными и легочными инфекциями, остеомиелитом, гепатоспленомегалией.
Вторичные нарушения фагоцитоза, как правило, развиваются на фоне медикаментозной терапии (при длительном применении цитостатиков). Специфический иммунитет осуществляется Т– и В-лимфоцитами. Становление всех систем как клеточного, так и неспецифического иммунного ответа начинается при сроках около 2–3 недель, когда формируются мультипотентные стволовые клетки. Общая стволовая клетка-предшественница всех субпопуляций лимфоцитов, нейтрофильных лейкоцитов и моноцитов может быть идентифицирована как СD34 + Т-клетки. К 9—15-й неделе жизни появляются признаки функционирования клеточного иммунитета. Реакции гиперчувствительности замедленного типа достигают наибольшего функционирования после рождения – к концу первого года жизни. Первичный лимфоидный орган – тимус – закладывается на сроке около 6 недель, и окончательное гистоморфологическое созревание претерпевает к возрасту гестации около 3 месяцев. С 6 недель у плода начинают типироваться HLA антигены, с 8–9 недели в вилочковой железе появляются малые лимфоциты, под влиянием гуморальных стимулов Т-лимфоциты дифференцируются в цитотоксические клетки, клетки-хелперы, супрессоры, клетки памяти. К моменту рождения абсолютное число Т-лимфоцитов у ребенка выше, чем у взрослого, но их характеристики ниже, чем у взрослых. Дифференцировка В-клеток начинается в печени или костном мозге. В ходе дифференцировки В-лимфоцитов осуществляется делеционная рекомбинация с генами иммуноглобулинов.
Превращение пре-В-клеток в клетки, способные к продукции иммуноглобулинов, осуществляется под влиянием факторов тимуса.
Для окончательного созревания В-клеток с возможностью трансформации их в плазматические необходимо участие стромальных элементов лимфатических узлов, пейеровских бляшек кишечника, селезенки. Способность к продукции антител собственными клетками В-системы подтверждена у плода начиная с 11–12 недель.
Синтез иммуноглобулинов в период внутриутробного развития весьма ограничен, в период внутриутробного развития к плоду трансплацентарно переходят некоторые иммуноглобулины матери (IgG). Ребенок получает от матери широкий комплекс специфических антител (как противобактериальных, так и противовирусных).
В течение первых месяцев жизни продолжаются распад и удаление тех иммуноглобулинов класса G, которые были переданы трансплацентарно. Одновременно происходит нарастание уровней иммуноглобулинов всех классов уже собственного производства.
В течение первых 4–6 месяцев материнские иммуноглобулины полностью разрушаются, и начинается синтез собственных иммуноглобулинов. В-лимфоциты синтезируют преимущественно IgМ, уровень которого быстрее достигает показателей, свойственных взрослым, синтез собственного IgG происходит более медленно.
К рождению у ребенка отсутствуют секреторные иммуноглобулины, их следы начинают обнаруживаться с конца первой недели жизни, содержание секреторного IgA достигает максимальных значений лишь к 10–12 годам. Состояния в иммунной системе обозначается как физиологическая транзиторная гипоиммуноглобулинемия детей раннего возраста. Возрастные физиологические особенности иммунитета у детей раннего возраста определяют значительное повышение их чувствительности как к инфекционным факторам среды, так и к аллергенной экспозиции, в связи с чем необходимо полноценное грудное вскармливание.
Молозиво и нативное женское молоко, содержащие большое количество IgA, макрофагов и лимфоцитов, компенсируют незрелость общего и местного иммунитета у детей первых месяцев жизни.
Повышение уровня сывороточных и секреторных иммуноглобулинов к 5 годам совпадает со снижением уровня инфекционной заболеваемости.
3. Семиотика нарушений иммунитета у ребенка
Диагноз по особенностям иммунологической реактивности может быть поставлен лишь в результате оценки течения перенесенных заболеваний и реакций в совокупности с лабораторными показателями.
Иммунологическая несостоятельность по типу первичного иммунодефицита В-клеточной системы проявляется:
1) повторными и тяжелыми гнойными заболеваниями, вызываемыми стрептококками, пневмококками, редко грибковыми и вирусными заболеваниями;
2) отитами, синуситами, повторными пневмониями, гнойными конъюктивитами в анамнезе, требующими нескольких курсов антибактериального лечения;
3) диарейными болезнями или расстройствами, связанными с лямблиозом;
4) умеренным отставанием в росте.
Возможный первоначальный иммунодефицит Т-клеточной системы характеризуется:
1) повторными тяжелыми инфекциями, вызываемыми вирусами, грибковыми осложнениями, инвазиями простейшими, упорными гельминтозами;
2) тяжелыми осложнениями на иммунизацию живыми вирусными вакцинами или вакциной BCG;
3) частыми диарейными расстройствами;
4) истощением, отставанием в росте и развитии;
5) концентрацией опухолевых заболеваний в семье.
Первичные фагоцитарные расстройства характеризуются:
1) повторными кожными инфекциями и грибковыми поражениями кожи с наиболее вероятными возбудителями, такими как стафилококк, псевдомонас, кишечная палочка;
2) абсцессами подкожной клетчатки, легких;
3) гнойными артритами и остеомиелитами.
Для недостаточности комплемента характерны:
1) повторные бактериальные инфекции, вызванные пиогенными возбудителями типа пневмококка или гемофильной палочки;
2) необычная чувствительность и частота гонококковой и менингококковой инфекций;
3) повторные тяжелые заболевания дыхательных путей и кожи;
4) концентрация в семье случаев системной красной волчанки, ревматоидного артрита или гломерулонефрита.
Специальные методы исследования, как правило, сложны, поэтому разработана последовательность обследования больных.
Сложный уровень диагностики – определение сывороточных цитокинов, методы кожного тестирования и функциональные пробы-провокации. Анамнез ребенка, характерный для атопической предрасположенности (диатеза):
1) концентрация в семье заболеваний типа поллиноза, бронхиальной астмы, экземы, дерматита, реакций непереносимости пищевых продуктов или медикаментов;
2) зудящие, повторяющиеся кожные сыпи, формирование устойчивых проявлений экземы или нейродермита;
3) связь кожных реакций и расстройств стула с введением в питание молочных смесей или блюд прикорма;
4) выраженное затруднение дыхания, «пыхтение» или одышка при некоторых простудных заболеваниях, физической нагрузке;
5) периодические приступы чиханья с зудом слизистой оболочки носа и обильным слизистым отделяемым;
6) периодические приступы слабости, головокружения, обильного потоотделения с ощущением зуда кистей, стоп, губ или языка.
Итак, для распознавания очень высокого риска атопической конституции у новорожденного можно использовать всего два критерия: наличие семейного атопического анамнеза (особенно по материнской линии) и лабораторное определение повышенного уровня иммуноглобулина Е в пуповинной крови.
Синдром приобретенного иммунодефицита. Дети заражаются преимущественно вертикально – от больной матери в период внутриутробного развития, частота инфицирования составляет до 30 %.
Вирусы приобретенного иммунодефицита человека сосредоточиваются в клетках лимфоидной системы, несущих маркер CD4, моноциты, клетки микроглии. Внутриутробное инфицирование и ранняя генерализация вируса являются причинами клинических проявлений множественных или сочетанных пороков развития, тканевых дисплазий, тяжелых энцефалопатий.
При более поздних сроках инфицирования возможно развитие синдромов, отражающих инфицирование, таких как:
1) изменение нервной системы с множественно-очаговыми поражениями;
2) синдром, напоминающий инфекционный мононуклеоз;
3) синдром поражения дыхательных путей в сочетании с лимфаденопатией;
4) диарейный синдром;
5) хроническая генерализованная лимфаденопатия;
6) прогрессирующая дистрофия.
При переходе заболевания в стадию вторичных инфекций выявляются различные бактериальные инфекции, включая туберкулез, микозы, вирусы цитомегалии и герпеса. Характерна пневмоцистная пневмония.
Специфическая диагностика ВИЧ-инфекции осуществляется по наличию антител к антигенам р17, р24, gр160.
При реальной неспособности к выработке антител диагностика может проводиться иммуногенетическими методами, ориентированными на выявление вирусного генома.
Источник
ÐоÑмалÑнÑй ÑоÑÑав пеÑиÑеÑиÑеÑкой кÑови Ñ Ð´ÐµÑей Ñазного возÑаÑÑа
пÑедÑÑавлен в Ñабл.1.
Ð 1-й меÑÑÑ Ð¶Ð¸Ð·Ð½Ð¸ в кÑови новоÑожденного еÑе много ÑеÑалÑного
гемоглобина (HbF). У недоноÑеннÑÑ ÑÑÐ¾Ð²ÐµÐ½Ñ ÑеÑалÑного гемоглобина Ð¼Ð¾Ð¶ÐµÑ ÑоÑÑавлÑÑÑ
80- 90% . РмоменÑÑ ÑÐ¾Ð¶Ð´ÐµÐ½Ð¸Ñ Ñебенка знаÑиÑелÑно ÑвелиÑиваеÑÑÑ ÑодеÑжание взÑоÑлого
гемоглобина (HbA), и ÑÑÐ¾Ð²ÐµÐ½Ñ ÐµÐ³Ð¾ пÑÐ¾Ð´Ð¾Ð»Ð¶Ð°ÐµÑ Ð¸Ð½ÑенÑивно наÑаÑÑаÑÑ Ð² ÑеÑение вÑего
1 меÑÑÑа жизни Ñебенка, а конÑенÑÑаÑÐ¸Ñ HbF Ñезко ÑнижаеÑÑÑ. Ð 3-4 меÑÑÑам в
ноÑме HbF в кÑови Ñебенка оÑÑÑÑÑÑвÑÑÑ.
ЦвеÑовой показаÑÐµÐ»Ñ Ð² пеÑвÑе 2- 3 недели жизни Ñебенка неÑколÑко
пÑевÑÑÐ°ÐµÑ ÐµÐ´Ð¸Ð½Ð¸ÑÑ (до 1,3), на 2 меÑÑÑе он Ñавен единиÑе, а заÑем ÑнижаеÑÑÑ
до велиÑин, ноÑмалÑнÑÑ Ð´Ð»Ñ Ð²Ð·ÑоÑлÑÑ (0,85- 1,15).
СкоÑоÑÑÑ Ð¾ÑÐµÐ´Ð°Ð½Ð¸Ñ ÑÑиÑÑоÑиÑов (СÐÐ) завиÑÐ¸Ñ Ð¾Ñ Ð¼Ð½Ð¾Ð³Ð¸Ñ ÑизиÑеÑкиÑ
и Ñ Ð¸Ð¼Ð¸ÑеÑÐºÐ¸Ñ ÑвойÑÑв кÑови. У новоÑожденнÑÑ Ð¾Ð½Ð° ÑоÑÑавлÑÐµÑ 2мм/ Ñ, Ñ Ð³ÑÑднÑÑ
4- 8, Ñ Ð±Ð¾Ð»ÐµÐµ ÑÑаÑÑÐ¸Ñ 4- 10, Ñ Ð²Ð·ÑоÑлÑÑ 5- 8 мм/ Ñ. Ðолее медленное оÑедание
ÑÑиÑÑоÑиÑов Ñ Ð½Ð¾Ð²Ð¾ÑожденнÑÑ Ð¾Ð±ÑÑÑнÑеÑÑÑ Ð½Ð¸Ð·ÐºÐ¸Ð¼ ÑодеÑжанием в кÑови ÑибÑиногена
и Ñ Ð¾Ð»ÐµÑÑеÑина, а Ñак же ÑгÑÑением кÑови.
РпеÑвÑе дни жизни Ñебенка наблÑдаеÑÑÑ Ð½ÐµÐ¹ÑÑоÑилÑнÑй лейкоÑиÑоз
Ñо Ñдвигом влево, ÑÑо обÑÑÑнÑеÑÑÑ Ð¿Ð¾ÑÑÑплением в оÑганизм Ñебенка ÑеÑез плаÑенÑÑ
маÑеÑинÑÐºÐ¸Ñ Ð³Ð¾Ñмонов, ÑгÑÑением кÑови в пеÑвÑе ÑаÑÑ Ð¶Ð¸Ð·Ð½Ð¸, ÑаÑÑаÑÑванием внÑÑÑиÑканевÑÑ
кÑовоизлиÑний, вÑаÑÑванием пÑодÑкÑов ÑаÑпада Ñканей Ñамого Ñебенка в ÑвÑзи Ñ
недоÑÑаÑоÑнÑм поÑÑÑплением пиÑи в пеÑвÑе дни жизни.
Таб.1 ÐоÑмалÑнÑй ÑоÑÑав пеÑиÑеÑиÑеÑкой кÑови Ñ Ð´ÐµÑей Ñазного возÑаÑÑа
| ÐозÑаÑÑ | УÑÐ¾Ð²ÐµÐ½Ñ Hb, г / л | ЧиÑло ÑÑиÑÑо- ÑиÑов 10^12/л | ÐÐ¾Ð»ÐµÐ±Ð°Ð½Ð¸Ñ ÑиÑла лейкоÑиÑов 10^9/л | ÐейÑÑо- ÑилÑ, % | Ðозино- ÑилÑ, % | Ðазо- ÑилÑ, % | ÐимÑо- ÑиÑÑ, % | Ðоно- ÑиÑÑ, % | ТÑомбо- ÑиÑÑ, 10^11 /л |
| ÐовоÑож- деннÑй | 215 | 5.7 | 10-30 | 53-82 | 0.6 | 0-4 | 5-56 | 15-34 | 2.69 |
| 2 недели | 180 | 5.1 | 9-12 | 18-46 | 1.5-6.5 | 0-2 | 22-69 | 8.5-28 | 2.04 |
| 1 меÑ. | 156 | 4.7 | 9-12 | 18-46 | 1.5-6.5 | 0-2 | 22-69 | 8.5-28 | 2.04 |
| 6 меÑ. | 123 | 4.6 | 9-12 | 18-46 | 1.5-6.5 | 0-2 | 22-69 | 8.5-28 | 2.04 |
| 1 год | 119 | 4.6 | 9-12 | 26-50 | 1-5 | 0-1 | 52-64 | 1-6 | 2-3 |
| 2 года | 118 | 4.0 | 7.1-15 | 26-50 | 1-5 | 0-1 | 52-64 | 1-6 | 2-3 |
| 4 года | 126 | 4.0 | 6.5-13 | 26-50 | 1-5 | 0-1 | 52-64 | 1-6 | 2-3 |
| 4-8 Ð»ÐµÑ | 128 | 4.2 | 5-12 | 40-50 | 1-5 | 0-1 | 34-48 | 1-6 | 2.5-4 |
| 8-14 Ð»ÐµÑ | 128 | 4.5 | 4.5-11 | 60-70 | 1-5 | 0-1 | 28-42 | 1-6 | 2.5-4 |
Источник