Анализ крови на мутации генов рака


Рак — заболевание, которое ежегодно уносит миллионы жизней, уступая среди причин смертности только сердечно-сосудистым патологиям. Ученые и врачи-онкологи уже давно ведут с ним борьбу, постоянно внедряя новые средства, которые помогают сохранить жизни всё большего числа пациентов. За последние десятилетия поле сражения сильно сместилось с гистологического и клеточного уровня на молекулярно-генетический.
Если раньше было лишь известно, что при раке меняется внешний вид и поведение клеток, то теперь ученые стремятся разобраться в процессах на уровне генов и отдельных молекул. Это стало возможным с развитием молекулярной биологии, и на этом поприще достигнуты немалые успехи.
Каждая клетка человеческого организма содержит около 30 тысяч генов. Среди них есть те, которые контролируют рост и размножение клетки, ее продолжительность жизни, отвечают за «починку» поврежденной ДНК.
Рак развивается из-за мутаций, в результате которых эти гены начинают работать неправильно. Генетические дефекты возникают случайно или при воздействии внешних факторов: курения, ультрафиолетового излучения, канцерогенов в пище и окружающей среде. Некоторые мутации (наследственные) человек получает от родителей, другие (приобретенные) — в течение жизни.
Каждый рак уникален, несет собственный набор мутаций. И эти различия могут сильно влиять на прогноз, чувствительность раковых клеток к тем или иным лекарственным препаратам. Выяснить это помогают специальные генетические анализы.
Показания:
Генетические исследования в онкологии помогают решать важные задачи:
- Обнаружить наследственные мутации и оценить риск развития рака, своевременно принять профилактические меры.
- Разобраться, есть ли у человека генетические дефекты, связанные с повышенным риском онкологических заболеваний, которые он может передать своим детям.
- Составить «молекулярно-генетический портрет» опухоли и выяснить, к каким препаратам она чувствительна.
Все генетические исследования на мутации, связанные с раком, можно разделить на две большие группы: те, которые проводят у здоровых людей, чтобы выявить риски, и те, которые проводят у онкологических больных, чтобы изучить опухолевые клетки и подобрать правильное лечение. Для каждой группы есть свои показания.
Анализы для людей, у которых уже диагностирован рак
Обычно такие исследования назначают при поздних стадиях онкологических заболеваний, когда стандартные методы лечения не помогают. Эти анализы применяют для диагностики заболевания, подбора персонализированной терапии и оценки прогноза.
Наиболее распространенные исследования из этой группы:
- При меланоме: исследования мутация в гене BRAF.
- При немелкоклеточном раке легкого: гены EGFR, BRAF, ALK.
- При раке толстой и прямой кишки: ген KRAS.
- При раке молочной железы: ген HER2.
- При раке яичников: гены BRCA1, BRCA2.
Эти мутации будут встречаться только в опухолевых клетках. В остальных, здоровых, тканях организма указанные гены будут функционировать нормально.
Анализы для здоровых людей, направленные на оценку рисков
Наследственные мутации человек получает от родителей. Они присутствуют в половых клетках, а значит, их получат все клетки тела человека. В настоящее время с помощью генетического теста можно определить повышенный риск развития следующих типов рака:
- яичников;
- молочной железы;
- щитовидной железы;
- толстой кишки;
- поджелудочной железы;
- простаты;
- желудка;
- почки.
Кроме того, генетические исследования помогают оценить риск меланомы, сарком — злокачественных опухолей из соединительной ткани.
Эксперты из Американского общества клинической онкологии (American Society of Clinical Oncology) рекомендуют рассмотреть возможность проведения генетических исследований на наследственные мутации людям, у которых в семье часто встречались определенные типы злокачественных опухолей, если такой диагноз был установлен у близких родственников. Правильное решение о необходимости обследования помогут принять онколог, клинический генетик.
Что показывает анализ?
Генетические тесты показывают, в каких генах произошли изменения, связанные с повышенным риском рака. Выделяют две группы генов, в которых могут возникать такие мутации.
Протоонкогены кодируют белки, активирующие деление клеток. В норме они должны «включаться» лишь в определенное время. Если в протоонкогене возникает мутация, либо он становится чрезмерно активным (например, из-за увеличения количества копий), он превращается в онкоген, и нормальная клетка становится опухолевой.
Распространенные примеры онкогенов — EGFR и HER2. Эти белки-рецепторы встроены в клеточную мембрану. При активации они запускают цепочку биохимических реакций, в результате чего клетка начинает активно, бесконтрольно размножаться. Все мутации в протоонкогенах — приобретенные, они не наследуются.
Гены-супрессоры опухолей ограничивают размножение клеток, восстанавливают поврежденную ДНК, отвечают за «смерть» отработавших своё клеток. Рак возникает из-за того, что в результате мутаций эти гены перестают справляться со своей функцией. Например, гены BRCA1 и BRCA2 отвечают за репарацию ДНК. При наследственных мутациях в них у женщин повышен риск того, что будет диагностирован рак молочной железы, яичников.
Европейская клиника сотрудничает с ведущими зарубежными лабораториями. Они применяют современные технологии секвенирования, которые помогают быстро изучить ДНК человека и выявить изменения в сотнях генов:
- замену оснований — «букв» генетического кода;
- делеции — утрату участка хромосомы;
- инсерции — «лишние» вставки ДНК в хромосомах;
- изменение числа копий определенного гена;
- фьюжн-мутации — слияние генов, в результате которого образуется новый, гибридный ген;
- микросателлитную нестабильность;
- мутационную нагрузку опухоли.
Существуют ли противопоказания?
Генетические тесты могут нести некоторые негативные эффекты. Когда здоровый человек узнаёт, что у него мутация, связанная с повышенным риском рака, это может стать сильным эмоциональным потрясением. Врач порекомендует рассказать об этом членам семьи, чтобы они тоже знали о рисках, и это может сделать семейную атмосферу более напряженной. Сам по себе генетический анализ стоит недешево. Если его проводят у онкологического больного для подбора персонализированной терапии, рекомендованные по результатам исследования препараты тоже могут оказаться очень дорогими.
Как происходит сдача анализа?
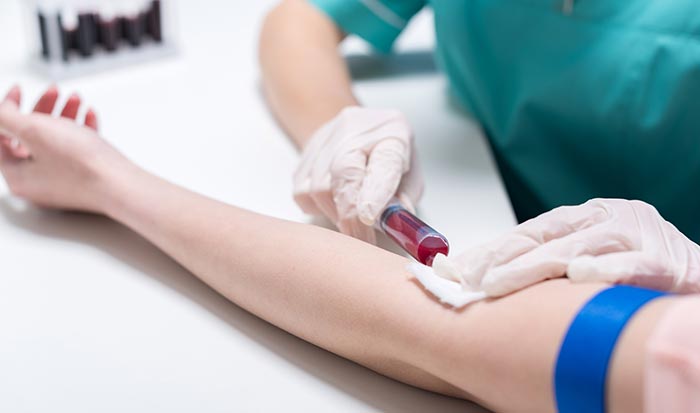
Если речь идет о наследственных мутациях, для анализа достаточно сдать кровь из вены. Для составления «молекулярно-генетического портрета» рака чаще всего нужен биоптат — образец ткани злокачественной опухоли. Существует и более современная методика — жидкостная биопсия, когда исследуют ДНК опухолевых клеток, циркулирующую в крови.
Насколько достоверны результаты?
Точность обнаружения мутаций с помощью современных генетических исследований составляет почти 95%.
Что может повлиять на точность результата?
Для того чтобы анализ показал достоверный результат, врач-онколог должен правильно провести биопсию, соблюдать технику фиксации (специальной обработки) ткани. Организация, которая отправляет материал в лабораторию, должна соблюдать правила транспортировки. В противном случае провести исследование не получится.

Расшифровка анализа
Если анализ на наследственные мутации показал отрицательный результат, это значит, что у человека нет генетических дефектов, повышающих риск развития тех или иных злокачественных опухолей. Но это не значит, что он никогда не заболеет раком. Просто его риски несколько ниже. Аналогично положительный результат не говорит о том, что у пациента обязательно будет диагностировано онкологическое заболевание. У него повышены риски, и, возможно, потребуются некоторые профилактические мероприятия.
Иногда результат исследования на наследственные мутации сомнителен. В таких случаях многие онкологи и клинические генетики предпочитают считать, что риск рака всё же повышен, и рекомендуют некоторые меры профилактики. В ряде случаев ситуацию помогают прояснить анализы близких родственников.
Иногда обнаруживают неизвестные изменения в генах. Непонятно, то ли это вариант нормы, то ли нейтральная мутация, то ли она повышает риск рака.
Если анализ проводится у онкологического пациента для подбора эффективного лечения, лаборатория высылает лечащему врачу отчет, в котором указывает:
- обнаруженные мутации;
- список научных публикаций, в которых эти мутации фигурируют;
- препараты, одобренные для лечения рака с такими генетическими дефектами;
- препараты, которые в настоящее время не одобрены для лечения данного типа рака, но успешно применяются для борьбы с другими злокачественными опухолями с аналогичными мутациями.
На основе этой информации онколог принимает решение по поводу дальнейшего лечения.
Генетические исследования на рак в Европейской клинике
В Европейской клинике есть всё для того, чтобы, при необходимости, назначить онкологическому пациенту персонализированную терапию, замедлить прогрессирование болезни и продлить жизнь. Мы применяем все препараты последних поколений, зарегистрированные на территории России, и сотрудничаем с ведущими европейскими, американскими лабораториями, которые проводят генетические исследования в онкологии.
Мы знаем, как помочь, если в другой клинике сказали, что больше ничего нельзя сделать, или лечение, назначенное ранее, перестало помогать. Свяжитесь с нами.
Запись
на консультацию
круглосуточно
Источник
31 августа 2019340,8 тыс.
Три эксперта в области онкологии о раке, наследственности и генетическом тестировании
Онкологические заболевания ежегодно уносят миллионы жизней. Среди причин смерти рак занимает второе место после сердечно-сосудистых заболеваний, а по сопровождающему его страху — определённо первое. Такая ситуация сложилась из-за представления, что рак сложно диагностировать и практически невозможно предотвратить.
Однако каждый десятый случай заболеваемости раком — это проявление мутаций, заложенных в наших генах с самого рождения. Современная наука позволяет их отловить и значительно уменьшить риск возникновения заболевания.
Эксперты в области онкологии рассказывают, что такое рак, как сильно на нас влияет наследственность, кому показано генетическое тестирование в качестве меры профилактики и как оно может помочь, если рак уже обнаружен.
Илья Фоминцев. Исполнительный директор Фонда профилактики рака «Не напрасно»
Рак — это, по сути, генетическое заболевание. Мутации, вызывающие онкологические заболевания, либо наследуются, и тогда они есть во всех клетках организма, либо появляются в какой-то ткани или конкретной клетке. Человек может унаследовать от родителей определённую мутацию в гене, который защищает от рака, или мутацию которая сама по себе может привести к раку.
Ненаследственные мутации возникают в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения.
В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет. Этот путь люди проходят гораздо быстрее, если уже при рождении они унаследовали поломку. Поэтому при опухолевых синдромах рак возникает в гораздо более молодом возрасте.
Прошлой весной вышла замечательная статья в Science — о случайных ошибках, которые возникают в ходе удвоения молекул ДНК и являются основным источником появления онкогенных мутаций. При таких видах рака, как рак простаты, их вклад может достигать 95%.
Чаще всего причиной возникновения рака являются именно ненаследственные мутации: когда никаких генетических поломок человек не унаследовал, но в течение жизни в клетках накапливаются ошибки, которые рано или поздно приводят к возникновению опухоли. Дальнейшее накопление этих поломок уже внутри опухоли может сделать её более злокачественной или привести к возникновению новых свойств.
Несмотря на то, что в большинстве случаев онкологические заболевания возникают из-за случайных мутаций, надо очень серьёзно относиться к наследственному фактору. Если человек знает об имеющихся у него унаследованных мутациях, он сможет предотвратить развитие конкретного заболевания, риск возникновения которого у него очень велик.
Влияние генов BRCA1 и BRCA1 на рак молочной железы
(источник: images.nature.com)
Есть опухоли с ярко выраженным наследственным фактором. Это, например, рак молочной железы и рак яичников. До 10% случаев заболеваемости этими видами рака связаны с мутациями в генах BRCA1 и BRCA2. Самый распространенный среди нашего мужского населения вид рака — рак лёгкого — в основной массе вызывается внешними факторами, а конкретнее — курением.
Но если предположить, что внешние причины исчезли, то роль наследственности стала бы примерно такой же, как и у рака молочной железы. То есть, в относительном соотношении для рака лёгкого наследственные мутации видны довольно слабо, но в абсолютных числах это всё же вполне существенно.
Кроме того, наследственный компонент довольно значительно проявляет себя в раке желудка и поджелудочной железы, колоректальном раке, опухолях головного мозга.
Антон Тихонов научный директор биотехнологической компании yRisk
Большая часть онкологических заболеваний возникает за счёт сочетания случайных событий на клеточном уровне и внешних факторов. Однако в 5-10% случаев предопределяющую роль в возникновении рака играет наследственность.
Представим себе, что одна из онкогенных мутаций появилась в половой клетке, которой повезло стать человеком. Каждая из примерно 40 триллионов клеток этого человека (а также его потомков) будет содержать мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой, а риск заболеть определённым видом рака у носителя мутации будет существенно выше.
Повышенный риск развития рака передаётся из поколения в поколение вместе с мутацией и называется наследственным опухолевым синдромом. Опухолевые синдромы встречаются достаточно часто — у 2-4% людей, и вызывают 5-10% случаев рака.
Анджелина Джоли сделала профилактические операции, поскольку три её близких родственницы умерли от рака молочных желез и яичников (источник: fs.kinomania.ru)
Благодаря Анджелине Джоли самым известным опухолевым синдромом стал наследственный рак молочной железы и яичников, который вызывается мутациями в генах BRCA1 и BRCA2. У женщин с этим синдромом риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания гораздо ниже — 5,6%. Увеличивается вероятность развития рака и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин еще и предстательной железе.
Наследственные формы есть практически у любого онкологического заболевания. Известны опухолевые синдромы, которые вызывают рак желудка, кишечника, мозга, кожи, щитовидной железы, матки и другие, менее распространённые типы опухолей.
Знать о том, что у вас или и у ваших родственников есть наследственный опухолевый синдром, может быть очень полезно для того, чтобы снизить риск развития рака, диагностировать его на ранней стадии, и эффективнее лечить заболевание.
Носительство синдрома можно определить с помощью генетического теста, а на то, что вам стоит сдать тест, укажут следующие особенности семейной истории.
- Несколько случаев одного вида рака в семье;
- Заболевания в раннем для данного показания возрасте (для большинства показаний – раньше 50 лет);
- Единичный случай определенного вида рака (например, рак яичников);
- Рак в каждом из парных органов;
- Больше одного типа рака у родственника.
Если для вашей семьи характерно что-либо из вышеперечисленного, вам следует проконсультироваться у врача-генетика, который определит, есть ли медицинские показания для того, чтобы сдавать генетический тест. Носителям наследственных опухолевых синдромов следует проходить тщательный скрининг на онкологические заболевания для того, чтобы обнаружить рак на ранней стадии. А в некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
Несмотря на то, что наследственные опухолевые синдромы встречаются очень часто, западные национальные системы здравоохранения пока не ввели генетическое тестирование на носительство мутаций в широкую практику. Тесты рекомендуется сдавать лишь при наличии определённой семейной истории, указывающей на определённый синдром, и только в том случае, если известно, что тестирование может принести человеку пользу.
К сожалению, такой консервативный подход пропускает множество носителей синдромов: слишком мало людей и врачей подозревает о существовании наследственных форм рака; высокий риск заболевания далеко не всегда проявляется в семейной истории; многие пациенты не знают о заболеваниях своих родственников, даже когда есть, кого спросить.
Всё это — проявление современной медицинской этики, которая гласит, что знать человеку стоит только то, что принесет ему больше пользы, чем вреда.
Причём право судить о том, что такое польза, что такое вред, и как они соотносятся друг с другом, врачи оставляют исключительно себе. Медицинское знание — такое же вмешательство в мирскую жизнь, как таблетки и операции, и поэтому меру знания должны определять профессионалы в светлых одеждах, а то как бы чего не вышло.
Я, как и мои коллеги, считаю, что право на знание о собственном здоровье принадлежит людям, а не врачебному сообществу. Мы делаем генетический тест на наследственные опухолевые синдромы, чтобы те, кто хочет узнать о своих рисках развития рака, могли реализовать это право, и взять на себя ответственность за собственную жизнь и здоровье.
Владислав Милейко директор Atlas Oncology Diagnostics
В процессе развития рака клетки изменяются и теряют свой первоначальный генетический «вид», унаследованный от родителей. Поэтому, чтобы использовать молекулярные особенности рака для лечения, недостаточно исследовать только наследственные мутации. Чтобы узнать слабые места опухоли, нужно провести молекулярное тестирование образцов, полученных в результате биопсии или операции.
Нестабильность генома позволяет опухоли копить генетические нарушения, которые могут быть выгодными для самой опухоли. К ним относятся мутации в онкогенах — генах, которые регулируют деление клеток. Такие мутации могут многократно повышать активность белков, делать их нечувствительными к тормозящим сигналам или вызывать повышенную выработку ферментов. Это приводит к неконтролируемому делению клеток, а впоследствии и к метастазированию.
Что такое таргетная терапия
Некоторые мутации имеют известные эффекты: мы знаем, как именно они меняют структуру белков. Это даёт возможность разработать лекарственные молекулы, которые будут действовать только на опухолевые клетки, и при этом не будут уничтожать нормальные клетки организма. Такие препараты называют таргетными. Чтобы современная таргетная терапия работала, нужно до назначения лечения знать, какие мутации есть в опухоли.
Эти мутации могут различаться даже в пределах одного типа рака (нозологии) у разных пациентов, и даже в опухоли одного пациента. Поэтому для некоторых лекарств молекулярно-генетическое тестирование рекомендовано в инструкции к препарату.
Определение молекулярных изменений опухоли (молекулярное профилирование) — важное звено в цепочке принятия клинических решений, а его значимость будет только расти со временем.
На сегодняшний день в мире проводится более 30 000 исследований противоопухолевой терапии. По разным данным, до половины из них используют молекулярные биомаркеры для включения больных в исследование или для наблюдения в ходе лечения.
Но что даст пациенту молекулярное профилирование? Где его место в клинической практике сегодня? Хотя для ряда лекарств тестирование является обязательным, это всего лишь «надводная часть айсберга» современных возможностей молекулярного тестирования. Результаты исследований подтверждают влияние различных мутаций на эффективность лекарств, а некоторые из них можно встретить в рекомендациях международных клинических сообществ.
Однако известно ещё не менее 50 дополнительных генов и биомаркеров, анализ которых может быть полезным в выборе лекарственной терапии (Chakravarty et al., JCO PO 2017). Их определение требует использования современных методов генетического анализа, таких как высокопроизводительное секвенирование (NGS). Секвенирование позволяет обнаружить не только распространенные мутации, но «прочитать» полную последовательность клинически значимых генов. Это позволяет выявить все возможные генетические изменения.
На этапе анализа результатов используются специальные биоинформатические методы, которые помогают выявить отклонения от нормального генома даже если важное изменение встречается в небольшом проценте клеток. Интерпретация полученного результата должна опираться на принципы доказательной медицины, так как не всегда ожидаемый биологический эффект подтверждается в клинических исследованиях.
Высокопроизводительное секвенирование позволяет анализировать огромные объёмы данных (источник: biology.reachingfordreams.com)
Из-за сложности процесса проведения исследований и интерпретации результатов молекулярное профилирование пока не стало «золотым стандартом» в клинической онкологии.
Однако есть ситуации, в которых этот анализ может существенно повлиять на выбор лечения:
Исчерпаны возможности стандартной терапии
К сожалению, даже на фоне правильно подобранного лечения заболевание может прогрессировать, и не всегда есть выбор альтернативной терапии в рамках стандартов для данного онкологического заболевания. В этом случае молекулярное профилирование может выявить «мишени» для экспериментальной терапии, в том числе в рамках клинических исследований (например TAPUR).
Спектр потенциально значимых мутаций широк
Некоторые виды рака, например, немелкоклеточный рак лёгкого или меланома, известны множеством генетических изменений, многие из которых могут быть мишенями для таргетной терапии. В таком случае молекулярное профилирование может не только расширить выбор возможных вариантов лечения, но и помочь расставить приоритеты при выборе препаратов.
Редкие виды опухолей или опухоли с изначально плохим прогнозом
Молекулярное исследование в таких случаях помогает на начальном этапе определить более полный спектр возможных вариантов лечения.
Молекулярное профилирование и персонализация лечения требуют сотрудничества специалистов из нескольких областей: молекулярной биологии, биоинформатики и клинической онкологии.
Поэтому такое исследование, как правило, стоит дороже обычных лабораторных тестов, а его ценность в каждом конкретном случае может определить только специалист.
Оригинал статьи опубликован на сайте Newtonew.
Ксения Жирнова, Profilaktika.Media.
Источник


