Анализ крови на морфологию клеток
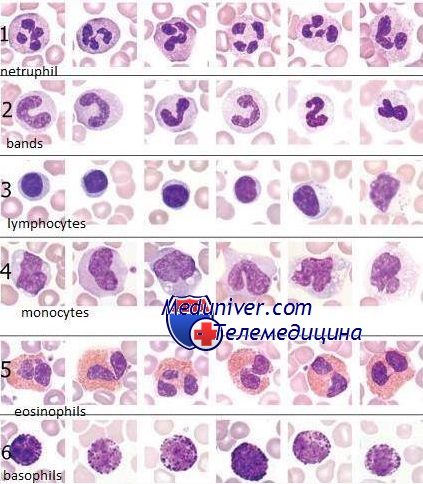
Морфологическое исследование клеток крови. Причины изменений
Морфологическое исследование эритроцитов, лейкоцитов, тромбоцитов и подсчет лейкоцитарной формулы производят в окрашенных мазках крови.
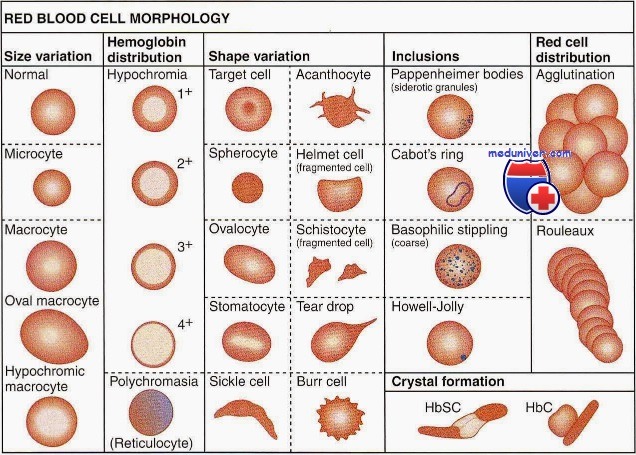
Качественная оценка эритроцитов имеет большое диагностическое и прогностическое значение. Обязательным является определение размеров и формы эритроцитов, их окраски, наличия и степени анизоцитоза и пойкилоцитоза, наличия патологических форм эритроцитов и включений в них.
При отсутствии автоматического анализатора для определения размеров эритроцитов измеряют их средний диаметр с построением эритроци-тометрической кривой Прайс-Джонса (гистограмма распределения эритроцитов по размеру). Диаметр нормальных эритроцитов в мазке равен 7-8 мкм, средний диаметр — 7,55 мкм.
Эритроциты размером более 8 мкм называются макроцитами (большие эритроциты с сохраненным просветлением в центре), более 12 мкм — мегалоциты или гигантоциты (гигантские эритроциты без просветления в центре). Эритроциты диаметром менее 6,5 мкм называются микроцитами, менее 2-3 мкм — шизоцитами. В норме в периферической крови выявляется 15,5% микроцитов и 16,5% макроцитов.
При использовании автоматического анализатора клеток крови проводится определение среднего объема эритроцитов (MCV), в зависимости от которого различают микроциты (MCV менее 75 мкм3), нормоциты (MCV в пределах 75-95 мкм3) и макроциты (MCV более 95 мкм3). На основании среднего объема эритроцитов строится эритроцитометрическая кривая.
Клиническое значение морфологического исследования клеток крови
При микроцитозе 30-50% от общего числа эритроцитов составляют микроциты. Микроцитоз наблюдается при ряде наследственных анемий (талассемии, гемоглобинопатии, микросфероцитоз, серповидноклеточная анемия, атрансферринемия, врожденная форма сидеробластной анемии).
Сдвиг эритроцитометрической кривой влево (увеличение количества эритроцитов малого диаметра) наблюдается при многих приобретенных анемиях (железодефицитные анемии, анемия хронических заболеваний, анемии при отравлении свинцом и др.).
При макроцитозе 50% и более от общего числа эритроцитов составляют макроциты. Макроцитоз чаще всего наблюдается при В12- и фолиеводефицитной анемиях.
Увеличение количества эритроцитов разного размера в мазке крови называется анизоцитозом. Это ранний признак анемии, наблюдающийся при ее легкой степени. Выделяют три степени анизоцитоза, которые обозначаются цифрами 1, 2 и 3.
Степень анизоцитоза эритроцитов (RDW — the Red cell Destribution Width) в современных гематологических анализаторах определяется автоматически. У здоровых людей большая часть эритроцитов (68%) представлена нормоцитами; микроциты составляют около 15%, макроциты — 17%. В норме RDW колеблется от 9,9 до 14,5%. При увеличении количества эритроцитов разного размера RDW нарастает.
В мазке крови большинство эритроцитов имеет округлую форму и только малая часть (до 10%) отличается по своей форме. Увеличение количества эритроцитов разной формы называется пойкилоцитозом. При этом эритроциты могут становиться овальными, грушевидными, звездчатыми, зазубренными и др.
Пойкилоцитоз является результатом продукции патологических клеток костным мозгом либо развивается вследствие повреждения нормальных клеток после выхода их из костного мозга в кровяное русло. Присутствие некоторых специфических форм эритроцитов (микросфероцитоз, эллиптоцитоз, стоматоцитоз) в большем количестве по сравнению с нормой имеет важное диагностическое значение.

Выделяют три степени пойкилоцитоза, которые также обозначаются цифрами 1, 2 и 3. Как и анизоцитоз, пойкилоцитоз является неспецифическим признаком любой анемии и отражает ее степень. Однако, в отличие от анизоцитоза, пойкилоцитоз появляется только при выраженной анемии и имеет более неблагоприятное прогностическое значение.
Эритроциты здоровых людей являются нормохромными, т. е. имеют равномерную окраску и небольшое (не более 1/3 диаметра клетки) просветление в центре. Гипохромия — увеличение центральной неокрашенной части эритроцита больше нормы. В зависимости от размеров просветления выделяют три степени гипохромии (1, 2, 3).
Усиленная окраска эритроцитов называется гиперхромией. Гиперхромия обусловлена увеличением объема эритроцитов и обычно сочетается с макроцитозом и мегалоцитозом. Более интенсивно окрашиваются микросфероциты.
В норме эритроциты окрашиваются кислыми красками, но молодые эритроциты с остатками ядерной субстанции (ретикулоциты) могут окрашиваться основными, приобретая различные оттенки серовато-сиреневого, серовато-фиолетового или серовато-голубого цвета. Эти клетки называются полихроматофилами. Полихроматофилия (полихромазия) — показатель усиленной регенерации костного мозга (наблюдается при гемолитических и постгеморрагических анемиях). В зависимости от числа полихроматофилов в поле зрения различают три степени полихромазии (1, 2, 3).
При различных состояниях в мазке крови могут обнаруживаться патологические формы эритроцитов (ядросодержащие — нормоциты), а также внутриэритроцитарные включения ядерного и цитоплазматического происхождения. Ядросодержащие эритроциты (синонимы: эритрокариоциты, нормоциты) в значительном количестве встречаются при гемолитических анемиях (прежде всего — гемолитическом кризе) и остром эритромиелозе (М6 по FAB-классификации).
Умеренный нормоцитоз наблюдается при постгеморрагических анемиях, сублейкемическом миелозе и метастазах злокачественных опухолей в костном мозге. Единичные нормоциты могут встречаться при В12-дефицитной анемии, миелодиспластических синдромах, хроническом миелолейкозе.
Среди внутриэритроцитарных включений ядерного происхождения различают тельца Жолли (круглые включения сине-фиолетового или вишнево-красного цвета диаметром 1-2 мкм), кольца Кебота (остатки ядерной оболочки в форме тонких нитеобразных колец, «восьмерки» или эллипса, окрашенные в красный цвет) и пылинки Вейденрейха (мелкая азурофильная, иногда голубая зернистость, чаще обнаруживается в мегалоцитах). Ядерные включения свидетельствуют о неэффективном эритропоэзе и встречаются при В12-дефицитных и гемолитических анемиях.
Кроме того, эритроциты с тельцами Жолли появляются после спленэктомии и при функциональной гипосплении и асплении у больных хроническими миелопролиферативными заболеваниями.
К внутриэритроцитарным включениям цитоплазматического происхождения относится базофильная пунктация (зернистость), которая представляет собой патологическую преципитацию вещества рибосом, перерожденных митохондрий и сидеросом и выглядит как точечная зернистость темно-синего цвета различной величины. Эритроциты с базофильной пунктацией встречаются при токсическом повреждении костного мозга (отравления свинцом, цинком, ртутью и др.), ряде анемий (талассемии, мегалобластные анемии), миелодиспластических синдромах и являются неблагоприятным прогностическим признаком.
— Также рекомендуем «Гематология: Лейкоцитарная формула в норме и при болезнях»
Оглавление темы «Гематология»:
- Гематология: История изучения крови
- Концепция единства кровяной ткани. Кровь как мезенхимальная ткань
- Гематология: Эмбриология крови — кровяной ткани
- Гематология: Клетки и цитокины регулирующие развитие В-клеток крови
- Гематология: Развитие Т-лимфоцитов и его регуляция
- Гематология: Развитие лимфоцитов в лимфатических узлах и селезенке
- Гематология: Рециркуляция лимфоцитов
- Клиническое обследование пациента в гематологии: сбор анамнеза, объективный осмотр
- Морфологическое исследование клеток крови. Причины изменений
- Гематология: Лейкоцитарная формула в норме и при болезнях
Источник
Общая характеристика крови
Кровь (sanguis) является одной из разновидностей соединительной ткани. Кровь состоит из плазмы и форменных элементов, формируется при взаимодействии многих органов и систем организма. К форменным элементам крови относятся эритроциты, лейкоциты и тромбоциты. Форменные элементы крови составляют около 45 % ее объема, а 55 % приходится на долю ее жидкой части — плазмы.
Кроме форменных элементов и плазмы к системе крови относятся лимфа, органы кроветворения и иммунопоэза (красный костный мозг, тимус, селезенка, лимфатические узлы, скопления лимфоидной ткани). Все элементы в системе крови взаимосвязаны гистогенетически и функционально и подчиняются общим законам нейрогуморальной регуляции.
В среднем количество крови составляет 6–8 % от массы тела человека; при весе 70 кг объем крови составляет приблизительно 5 литров.
Кровь является самой подвижной средой в организме, чутко реагирующей на весьма незначительные физиологические и тем более патологические сдвиги в организме.
По учету и оценке динамики изменений состава крови клиницист стремится познать процессы, происходящие в различных органах и тканях. Правильная и ранняя диагностика заболевания, целесообразное лечение, верный прогноз течения болезни часто бывают совершенно невозможны без данных морфологического и биохимического исследований крови. При этом исключительно важное значение имеют повторные исследования, так как динамика гематологических сдвигов в значительной мере отражает динамику патологического процесса.
Общие сведения о кроветворении
Все клетки крови развиваются из общей полипотентной стволовой клетки, дифференцировка (превращение) которой в различные виды клеток крови определяется как микроокружением (ретикулярная ткань кроветворных органов), так и действием специальных гемопоэтинов.
Процессы разрушения и новообразования клеток сбалансированы и, следовательно, поддерживается постоянство количества и состава крови.
Тесное взаимодействие между органами гемопоэза и иммунопоэза осуществляется путем миграции, циркуляции и рециркуляции клеток крови, нейрогуморальной регуляцией кроветворения и распределения крови.
В обычных условиях костномозговое кроветворение не только покрывает потребности организма, но и производит довольно большой запас клеток: зрелых нейтрофилов в костном мозге человека содержится в 10 раз больше, чем в кровеносном русле. Что касается ретикулоцитов, то в костном мозге имеется их трехдневный запас.
Исключительное значение для практической медицины и физиологии имеет вопрос о том, что следует считать гематологической нормой.
В табл. 1 приводятся среднестатистические величины показателей гемограммы жителей г. Харькова, рассчитанные авторами настоящего пособия за последние 3 года. Данные показатели были получены в клинической лаборатории Клинико-диагностического центра Национального фармацевтического университета.
Таблица 1. Усредненные показатели гемограмм здоровых жителей | ||
| Показатели | Пол | X Sx ± |
| Эритроциты, ×1012 | муж. | 4,39 ± 0,58 |
| жен. | 4,21 ± 0,43 | |
| Гемоглобин, г/л | муж. | 137,48 ± 15,32 |
| жен. | 121,12 ± 14,78 | |
| Цветовой показатель | 0,90 ± 0,04 | |
| Гематокрит | муж. | 0,46 ± 0,07 |
| жен. | 0,40 ± 0,06 | |
| Ретикулоциты, % | 7,20 ± 0,75 | |
| Тромбоциты, ×109/л | 315,18 ± 58,40 | |
| СОЭ, мм/час | муж. | 4,25 ± 2,15 |
| жен. | 3,10 ± 1,86 | |
| Лейкоциты, ×109/л | 5,84 ± 1,42 | |
| П/ядерные нейтрофилы, % | 1,58 ± 0,88 | |
| С/ядерные нейтрофилы, % | 61,42 ± 8,74 | |
| Эозинофилы, % | 2,35 ± 1,41 | |
| Лимфоциты, % | 31,78 ± 6,95 | |
| Моноциты, % | 4,04 ± 2,19 | |
Средние значения нормального содержания лейкоцитов, эритроцитов и гемоглобина по данным различных авторов не претерпели значительного изменения за последние сто лет. Следовательно, можно сделать вывод о стабильности кроветворения, несмотря на вызванные научно-техническим процессом изменения сферы обитания человека.
Из других клеточных элементов значение имеют:
Плазмоциты (plasmocytus)
Плазмоцит (plasmocytus) — клетка лимфоидной ткани, продуцирующая иммуноглобулины. Имеет ядро колесовидной формы и резко базофильную вакуолизированную цитоплазму (рис. 14).
У здорового человека плазмоциты присутствуют в костном мозге и лимфатических тканях, реже — в периферической крови.
В крови появляются в небольшом количестве (0,5–3 %) при любом инфекционном и воспалительном процессе:
- вирусных инфекциях (краснуха, скарлатина, корь, коклюш, вирусный гепатит, аденовирусная инфекция, инфекционный мононуклеоз),
- опухолях,
- сывороточной болезни,
- коллагенозах,
- после облучения.
LE-клеточный феномен
LE-клеточный феномен включает следующие образования:
- гематоксилиновые тела,
- «розетки»,
- LE-клетки.
Из трех указанных образований наибольшее значение придают обнаружению LE-клеток.
LE-клетки (клетки красной волчанки, клетки Харгрейвса) — зрелые гранулоциты, ядра которых оттеснены к периферии фагоцитированным ядерным веществом другой клетки (рис. 15).
Появляются при:
- системной красной волчанке (80 % больных);
- ревматоидном артрите;
- остром гепатите;
- склеродермии;
- лекарственных волчаночноподобных синдромах (прием противосудорожных препаратов, прокаинамида, метилдопы).
Морфологическое исследование крови
Полное морфологическое исследование крови человека весьма обширно и длительно, поэтому проводится лишь в особых случаях или с научной целью.
При обследовании больного обычно применяется исследование крови, которое носит название общий клинический анализ.
Этот анализ включает изучение количественного и качественного состава форменных элементов крови:
- определение количества гемоглобина;
- определение числа эритроцитов;
- расчет цветового показателя;
- определение числа лейкоцитов и соотношение отдельных форм среди них;
- определение скорости оседания эритроцитов (СОЭ).
У некоторых больных в зависимости от характера заболевания производят дополнительные исследования:
- подсчет ретикулоцитов,
- тромбоцитов,
- определение времени свертывания.
Для клинического анализа берут периферическую кровь. При этом кровь у больного желательно брать утром, до еды, так как прием пищи, лекарств, внутривенные введения, мышечная работа, температурные реакции и другие факторы могут вызвать различные морфологические и биохимические изменения в составе крови.
Техника взятия крови
Взятие крови следует проводить в резиновых перчатках, соблюдая правила асептики, обрабатывая перчатки 70° спиртом перед каждым взятием;
Кровь берут из концевой фаланги 4-го пальца левой руки (в особых случаях можно брать из мочки уха или из пятки — у новорожденных и грудных детей);
Место прокола предварительно протирают ватным тампоном, смоченным в 70° спирте; кожа должна высохнуть, иначе капля крови будет растекаться;
Для прокола кожи пользуются одноразовой стерильной иглойскарификатором;
Прокол следует делать на боковой поверхности пальца, где капиллярная сеть гуще, на глубину 2–3 мм; разрез (прокол) рекомендуется производить поперек дактилоскопических линий пальца, так как в этом случае кровь идет легко и обильно;
Первую каплю крови следует удалить, так как она содержит большое количество тканевой жидкости; после каждого взятия крови ее остатки на пальце вытирают и последующее взятие производят из вновь выступающей капли;
После взятия крови к раневой поверхности прикладывают новый стерильный тампон, смоченный 70° спиртом.
Источник
Соколова Н. А.
Ремедиум Приволжье, № 3 (172) 2019
Общий анализ крови (ОАК) является самым распространенным тестом, который выполняется в лечебно-профилактических учреждениях различного профиля. Данные, получаемые при интерпретации результатов ОАК, позволяют выявить нарушения функционирования системы кроветворения, отслеживать протекание воспалительных процессов, заподозрить наличие онкогематологического заболевания у пациентов.
![]()
Схема выполнения ОАК в настоящее время включает в себя проведение автоматизированного исследования периферической крови с помощью гематологического анализатора, измерения скорости оседания эритроцитов, затем при необходимости (во многом это зависит от типа анализатора, которым оснащена лаборатория) изучения окрашенных по Романовскому-Гимзе мазков периферической крови.
Поскольку более чем в 70% лабораторий в РФ установлены гематологические анализаторы, осуществляющие дифференцировку лейкоцитов только на три популяции, то основным методом подсчета лейкоцитарной формулы в нашей стране является метод световой микроскопии окрашенных мазков крови.
Одной из проблем при описании морфологических особенностей клеток крови является отсутствие четких рекомендаций, как именно это делать, обязательных для всех врачей клинической лабораторной диагностики. Данный вопрос актуален не только для нашей страны, схожие проблемы имеются во всем мире.
Разные клинические школы в лабораторной медицине, традиции, существенный субъективизм в оценке изменений клеток крови приводят в целом к существенным затруднениям в работе клиницистов, особенно при сравнении анализов, полученных из различных лабораторий. Международным комитетом по стандартизации в гематологии (ICSH) в 2011 году была инициирована работа по разработке общей номенклатуры и рекомендаций по описанию клеток крови.
На протяжении ряда лет ведущие эксперты из стран Европы, Азии, Америки занимались данной проблемой, проводились рабочие встречи, конференции, посвященные данному вопросу. В результате в 2015 году были выработаны четкие рекомендации с учетом специфики оснащенности оборудованием лабораторий в разных странах.
Основными положениями в данных рекомендациях были следующие:
- Необходимо в первую очередь опираться на данные гематологического анализатора при интерпретации результатов исследования, особенно это касается изменений эритроцитов: такие параметры, как MCV, MCH, MCHC, RDW, объективно отражают изменения размеров и гемоглобинизации эритроцитов.
- В каждой лаборатории должны быть разработаны собственные алгоритмы действий, например, в каких случаях готовить окрашенные мазки крови при появлении «флагов» при исследовании крови на гематологическом анализаторе. Невозможно представить общую схему, поскольку существует огромная разница между моделями гематологических анализаторов в настоящее время (простейшие 8−20-параметровые счетчики и сложнейшие анализаторы с возможностью исследования клеток методом проточной цитометрии).
- При описании степени выявленных изменений избавиться от градации «малой/слабой степени» и т. п., поскольку информация, поступающая из лаборатории, должна быть в первую очередь клинически значимой. Были выбраны количественные критерии, когда те или иные особенности являются уже значимыми, и предложено обозначать степень выраженности для большинства параметров, используя двухуровневую систему — умеренно выраженные изменения/умеренное количество (++) и резко выраженные изменения/много (+++).
Проведение исследования крови на гематологическом анализаторе обеспечивает точный подсчет числа эритроцитов, определение объема клеток, рассчитываются несколько эритроцитарных индексов. При появлении отклонения от референсных интервалов данных показателей, появлении сигналов об ошибках измерения и других «флагов» необходимо решить вопрос о приготовлении окрашенных препаратов крови и
изучении морфологии эритроцитов в мазках.
При определении степени выраженности анизоцитоза, пойкилоцитоза, включений в эритроциты следует произвести ориентировочный подсчет: какое число эритроцитов являются, например, сфероцитами среди 100 эритроцитов. Если более 5% — это клинически значимое число, руководствуемся таблицей 1 для правильного заполнения граф «анизоцитоз», «пойкилоцитоз» и прочих в ОАК.
| Наименование морфологических особенностей | Умеренно выраженные изменения (++) | Резко выраженные изменения (+++) |
| Макроциты | 11−20% | >20% |
| Овальные макроциты | 2−5% | >5% |
| Микроциты | 11−20% | >20% |
| Гипохромные эритроциты | 11−20% | >20% |
| Полихроматофильные эритроциты | 5−20% | >20% |
| Акантоциты | 5−20% | >20% |
| Укушенные эритроциты | 5−20% | >20% |
| Эхиноциты | 5−20% | >20% |
| Овалоциты | 5−20% | >20% |
| Шизоциты | >2% | |
| Серповидные эритроциты | 1−2% | >2% |
| Сфероциты | 5−20% | >20% |
| Стоматоциты | 5−20% | >20% |
| Мишеневидные эритроциты | 5−20% | >20% |
| Дакриоциты | 5−20% | >20% |
| Базофильная зернистость | 5−20% | >20% |
| Тельца Жолли | 2−3% | >3% |
| Тельца Папенгеймера | 2−3% | >3% |
Следует обратить внимание на шизоциты — их обнаружение играет огромную роль в диагностике таких жизнеугрожающих заболеваний, как гемолитико-уремический синдром, тромботическая тромбоцитопеническая пурпура и ряда других. В связи с этим даже обнаружение их в количестве менее 1% следует отмечать в бланке результата исследования.
Шизоциты — фрагменты разрушенных эритроцитов, которые образуются при внешнем воздействии на эритроциты в ходе их циркуляции в сосудистом русле, чаще всего в ходе их повреждения на нитях фибрина в микроциркуляторном русле. Редкой находкой являются тельца Папенгеймера, которые представляют собой агрегаты ферритина светлофиолетового цвета, выявляемые иногда при обычной окраске по Романовскому-Гимзе в сидероцитах.
Размеры, форма данных включений варьируют. Чаще они лежат в определенных областях эритроцита (не по всей поверхности клетки), что отличает их от базофильной зернистости. Встречаются тельца Папенгеймера при сидеробластных анемиях. С отечественными рекомендациями по описанию морфологии эритроцитов можно ознакомиться, например, в справочнике под редакцией профессора А.И. Карпищенко, где представлены указания по оценке выраженности анизоцитоза и пойкилоцитоза: предлагается выделять три степени анизоцитоза (слабо выраженный, умеренно выраженный или резко выраженный, что допустимо также обозначать в бланке в виде крестов); три степени пойкилоцитоза по такой же схеме.
Если 50% эритроцитов в поле зрения представлены клетками разного размера или отличающимися от нормального размера: микро- или макроцитами, анизоцитоз оценивается как слабовыраженный (+); если от 50 до 75% эритроцитов в поле зрения представлены клетками разного размера, то анизоцитоз оценивается как умеренно выраженный (++); если более 75% эритроцитов в поле зрения представлены клетками разного размера, то резко выраженный (+++).
Минусами такого подхода являются трудности в оценке слабовыраженных изменений, отсутствие четких требований к подсчету анизоцитов и пойкилоцитов в мазке крови и, как следствие, большие расхождения в оценке изменений эритроцитов, выполненные в разных лабораториях. Подсчет лейкоцитарной формулы может выполняться методом световой микроскопии или же с помощью гематологического анализатора.
Если подсчет ведется методом световой микроскопии, то согласно рекомендациям ВОЗ (2008) должно быть подсчитано минимум 200 лейкоцитов при наличии признаков онкогематологического заболевания у пациента. В рутинной практике подсчитывается, как правило, 100 клеток. Следует обратить внимание, что бласты, плазматические клетки, промиелоциты, пролимфоциты включаются в лейкоцитарную формулу как отдельный вид клеток.
По морфологии невозможно дифференцировать бластные клетки (миелобласты, лимфобласты, монобласты), поэтому используется термин «бласты» или «бластные клетки». Промоноциты рекомендуется считать эквивалентом бластных клеток при подсчете лейкоцитарной формулы крови. В бланке результата исследования указываются морфологические особенности бластов (размер клеток, особенности строения ядра, цвет цитоплазмы, вакуолизация, наличие азурофильной зернистости и т. д.).
Особенно внимательно следует относиться к бластам с необычными ядрами (складчатыми, скрученными, моноцитоидными) и с наличием в цитоплазме грубой азурофильной зернистости и палочек Ауэра («атипичные промиелоциты»), поскольку любое подозрение на острый промиелоцитарный лейкоз должно быть отражено в бланке ОАК и служить основанием для немедленных действий в отношении больного. ICSH рекомендует отмечать в обязательном порядке в бланке исследования наличие палочек Ауэра в бластных клетках, телец Князькова-Деле, токсическую (токсогенную/токсигенную) зернистость или гипергранулярность нейтрофилов, гипогранулярность нейтрофилов и вакуолизацию цитоплазмы (таблица 2).
| Наименование морфологических особенностей | Умеренно выраженные изменения (++) | Резко выраженные изменения (+++) |
| Тельца Князькова-Деле | 2−4% | >4% |
| Вакуолизация нейтрофилов | 4−8% | >8% |
| Гипергранулярность нейтрофилов | 4−8% | >8% |
| Гипогранулярность нейтрофилов | 4−8% | >8% |
Есть определенные сложности в использовании терминов для описания гипергранулярности нейтрофилов. В 60−80 гг. ХХ века в ведущих руководствах того времени уже появляется два термина — «токсогенная зернистость» и «токсигенная зернистость». Несколько позже начинает встречаться термин «токсическая зернистость нейтрофилов».
В приложении к приказу № 1030 от 04.10.1980 (приказ отменен, но есть рекомендация в письме Министерства здравоохранения и социального развития Российской Федерации от 30.112009 № 14−6/242888 пользоваться альбомом форм приказа № 1030) имеется форма № 224/у, в которой предлагается при описании морфологии лейкоцитов использовать термин «токсогенная зернистость».
Гиперсегментация нейтрофилов — это состояние, при котором в любом количестве встречаются нейтрофилы с числом сегментов более пяти. ICSH дает еще более строгое определение гиперсегментации: при наличии в периферической крови 3% и более нейтрофилов с пятью сегментами.
Гипосегментация нейтрофилов формируется по причине нарушения нормального созревания ядра на конечном этапе дифференцировки нейтрофилов. ICSH рекомендует отмечать наличие как гиперсегментации в бланке исследования крови, так и гипосегментации. Также в данном документе подчеркивается, что в случае гипосегментации при подсчете лейкоцитарной формулы нельзя клетки с круглым ядром относить к миелоцитам или метамиелоцитам, поскольку структура хроматина в этих нейтрофилах зрелая.
Следует дифференцировать данные клетки на палочкоядерные и сегментоядерные формы (если есть сегментация ядра). Морфологические особенности (форма ядра, число сегментов, структура хроматина) следует описать в виде комментария в бланке исследования. При лимфопролиферативных заболеваниях можно обнаружить при исследовании мазков периферической крови лимфоциты с признаками атипии, которые, вероятно, принадлежат опухолевому клону.
ICSH рекомендует использовать в отношении этих клеток термин «аномальные» или «атипичные» лимфоциты. Обнаруженные клетки со своеобразной морфологией при первичном исследовании крови у пациента следует подсчитывать отдельно, относить к атипичным лимфоцитам и сопровождать подробным описанием их морфологии.
В последующем, если диагноз у данного пациента точно установлен, мы можем подсчитывать их как клетки лимфомы или, допустим, волосатые клетки, характерные для волосатоклеточного лейкоза, уже без подробного морфологического описания. Нормальный диаметр тромбоцитов — 1,5−3 мкм. Если диаметр тромбоцитов составляет 3−7 мкм (приближается к размеру эритроцитов-нормоцитов), то это популяция больших тромбоцитов (макротромбоцитов, макроформ), если диаметр 10−20 мкм — это гигантские тромбоциты (мегалоформы), наличие которых отмечается гематологическими анализаторами в виде соответствующего флага. У здоровых людей менее 5% тромбоцитов являются макротромбоцитами.
При хранении венозной крови, стабилизированной калиевыми солями ЭДТА, постепенно происходит увеличение размера тромбоцитов. В случае обнаружения гиганстких тромбоцитов следует отметить их наличие в виде комментария в бланке исследования по следующей схеме: 11−20% — умеренное количество (++), более 20% — значительное количество (много; +++).
В редких случаях обнаруживаются гипогранулярные тромбоциты (в центре тромбоцита отсутствует азурофильная зернистоть, «голубые пластинки»), и в этом случае это обязательно отражается в бланке исследования. Широкое применение ОАК связано с тем, что полученные данные позволяют заподозрить наличие многих заболеваний у пациента, в том числе и онкогематологических. В связи с этим очень важно, чтобы врачи клинической лабораторной диагностики имели высокий навык в распознавании клеток крови и умели грамотно описывать их морфологические изменения.
Источник


