Анализ крови на концентрацию лекарства в крови
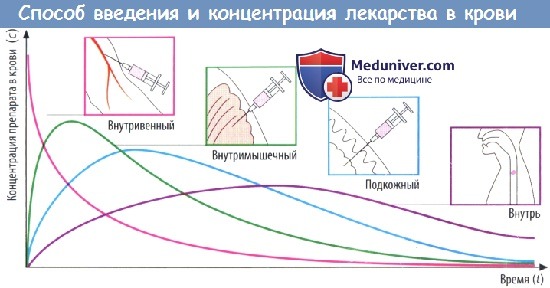
Концентрация лекарства в крови после введения
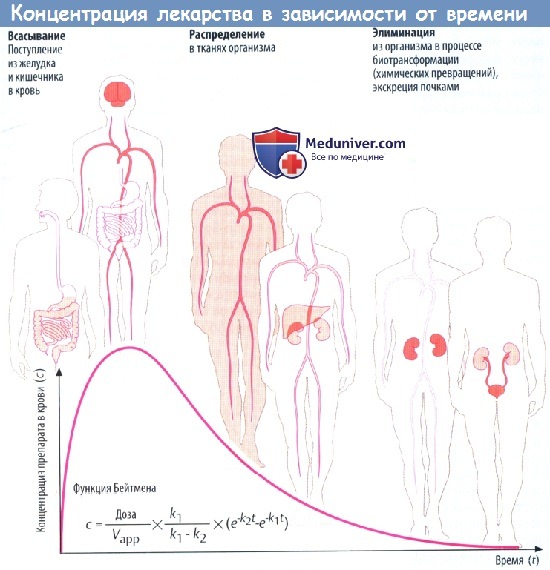
(А) Лекарственные средства попадают в организм и выводятся из него разными путями. Таким образом, организм представляет собой открытую систему, в которой фактическая концентрация препарата отражает взаимодействие между его поступлением (приемом) и эвакуацией (элиминацией).
Скорость всасывания препарата в желудке и кишечнике зависит от множества факторов: скорости растворения вещества (в случае приема твердой лекарственной формы) и транзита по ЖКТ, проницаемости слизистой для препарата, его градиента концентрации на границе слизистой и крови,кровоснабжения слизистой оболочки.
Всасывание из кишечника приводит к повышению концентрации лекарственного вещества в крови. Препарат разносится с кровью к различным органам (распределение), которые поглощают его в количестве, соответствующем его химическим свойствам и скорости кровотока через орган.
Например, органы с хорошим кровоснабжением, такие как головной мозг, получают большее количество препарата, чем органы с низким кровоснабжением. В результате поглощения тканями происходит снижение концентрации лекарственного вещества в крови. По мере снижения градиента на границе слизистой оболочки и крови всасывание в кишечнике замедляется. Пик концентрации в крови достигается тогда, когда количество вещества, покидающего кровь за единицу времени, равно количеству всосавшегося.
Поступление вещества в ткани печени и почек представляет собой перемещение в органы выведения. Концентрация препарата в крови в различные периоды времени представляет собой совокупность процессов абсорбции, распределения и элиминации, которые пересекаются во времени.
Если распределение происходит значительно быстрее, чем элиминация, снижение концентрации в крови вначале происходит быстро, а затем замедляется. Фаза быстрого снижения обозначается как α-фаза (фаза распределения), медленного — как β-фаза (фаза элиминации). Если препарат распределяется быстрее, чем абсорбируется, концентрацию препарата в крови можно описать математически упрощенной функцией Бейтмена (k1 и k2 — константы скорости для абсорбции и элиминации соответственно).

(В) Скорость абсорбции зависит от способа введения препарата. Чем выше скорость абсорбции, тем короче будет время (tmax), которое требуется для достижения пика концентрации в плазме (cmax), тем выше будет cmax и тем раньше уровень препарата в крови снова начнет снижаться.
Площадь под кривой, описывающей зависимость концентрации препарата в крови от времени (AUC), не зависит от пути введения препарата при условии, что доза и биодоступность остаются теми же (закон соответственных состояний). Таким образом, AUC можно использовать для вычисления биодоступности (F) препарата.
Значение AUC, измеренное после приема внутрь и в/в введения определенной дозы конкретного лекарственного вещества, соответствует проценту вещества, попавшего в системный кровоток после приема внутрь: F = AUCприем внутрь/AUCв/в введение.
Определение концентрации препарата в крови позволяет сравнить различные патентованные лекарственные средства, содержащие одно и то же действующее вещество в одинаковой дозе. Идентичные кривые зависимости концентрации в крови от времени для препаратов различных производителей (при условии стандартных лекарственных форм) означают биоэквивалентность стандартного вещества и нового исследуемого препарата.
— Также рекомендуем «Концентрация лекарства в крови при регулярном и нерегулярном приеме»
Оглавление темы «Фармакокинетика лекарств»:
- Механизм выделения лекарств через почки
- Потери лекарства в зависимости от метода поступления — пресистемная элиминация
- Концентрация лекарства в организме в зависимости от времени
- Концентрация лекарства в крови после введения
- Концентрация лекарства в крови при регулярном и нерегулярном приеме
- Механизмы накопления лекарства в организме
- Зависимость эффекта лекарства от дозы
- Зависимость эффекта лекарства от концентрации
- Связывание лекарства с рецептором в зависимости от концентрации
- Типы связывания лекарства с рецептором
Источник
Метод определения
Газовая хроматография/масс-спектрометрия (ГХ-МС).
Исследуемый материал
Сыворотка крови
Леветирацетам (Кеппра) – противоэпилептический препарат II поколения — обладает уникальным механизмом действия, отличным от механизма действия любого другого противоэпилептического препарата. Препарат связывается с белками плазмы менее чем на 10%, не стимулирует и не ингибирует печеночные ферменты, что обеспечивает минимальный риск лекарственных взаимодействий с другими препаратами. Леветирацетам относится к препаратам, не требующим длительной титрации. Его действие начинается уже в первый день применения. Фармакокинетика. После приема внутрь леветирацетам хорошо абсорбируется из желудочно-кишечного тракта. Всасывание происходит полностью и носит линейный характер, благодаря чему концентрация в плазме крови может быть предсказана, исходя из принятой дозы леветирацетама, выраженной в мг/кг массы тела. Степень всасывания не зависит от дозы и времени приема пищи. Биодоступность составляет примерно 100 %. Максимальная концентрация в плазме достигается через 1,3 ч после перорального приема леветирацетама в дозе 1000 мг и при однократном приеме составляет 31 мкг/мл, после повторного приема (2 раза в сутки) — 43 мкг/мл. Равновесное состояние достигается через 2 суток при двукратном приеме препарата. Фармакокинетика леветирацетама у детей носит линейный характер в интервале доз от 20 до 60 мг/кг/сут, максимальная концентрация достигается через 0,5-1 ч. Связывание леветирацетама и его основного метаболита с белками плазмы составляет менее 10 %. Выведение. Период полувыведения (Т1/2) из плазмы крови взрослого человека составляет 7 + 1 ч и не зависит от способа введения и режима дозирования. 95 % препарата выводится почками. У пациентов пожилого возраста Т1/2 увеличивается на 40 % и составляет 10-11 ч, что связано с нарушением функции почек у этой категории людей. У пациентов с нарушением функции почек клиренс леветирацетама и его первичного метаболита коррелирует с клиренсом креатинина. Поэтому пациентам с почечной недостаточностью рекомендуется подбор дозы в зависимости от клиренса креатинина. У пациентов с нарушением функции печени легкой и средней степеней тяжести значимых изменений клиренса леветирацетама не происходит. У большинства пациентов с тяжелыми нарушениями функции печени при сопутствующей почечной недостаточности клиренс леветирацетама снижается более чем на 50 %. Т½ у детей после однократного перорального введения препарата в дозе 20 мг/кг массы тела составляет 5-6 ч. Побочное действие Возможные побочные эффекты приведены ниже по системам организма и частоте возникновения: очень часто (> 1:10), часто (> 1:100, < 1:10). Со стороны нервной системы. Очень часто: сонливость, астенический синдром. Часто: амнезия, атаксия, судороги, головокружение, головная боль, гиперкинезия, тремор, нарушение равновесия, снижение концентрации внимания, ухудшение памяти, возбуждение, депрессия, эмоциональная лабильность, переменчивость настроения, враждебность/агрессивность, бессонница, нервозность, раздражительность, расстройства личности, нарушение мышления. Отдельные сообщения: парестезии, поведенческие расстройства, тревожность, беспокойство, спутанность сознания, галлюцинации, раздражительность, психотические расстройства, суицид, попытки суицида и суицидальные намерения. Со стороны органа зрения. Часто: диплопия, нарушение аккомодации. Со стороны дыхательной системы. Часто: усиление кашля. Со стороны пищеварительной системы. Часто: абдоминальная боль, диарея, диспепсия, тошнота, рвота, анорексия, повышение массы тела. Отдельные сообщения: панкреатит, печеночная недостаточность, гепатит, изменения функциональных печеночных проб, снижение массы тела. Со стороны кожных покровов. Часто: кожная сыпь, экзема, зуд. Отдельные сообщения: алопеция (в ряде случаев восстановление волосяного покрова наблюдалось после отмены препарата). Изменения лабораторных показателей. Отдельные сообщения: лейкопения, нейтропения, панцитопения (в некоторых случаях с угнетением функции костного мозга), тромбоцитопения. Прочие. Отдельные сообщения: инфекции, назофарингит, миалгия. Передозировка. Симптомы: сонливость, тревожность, агрессивность, угнетение сознания, угнетение дыхания, кома.
Литература
- Кальвиайнен Р. Влияние противоэпилептических препаратов на когнитивные функции и поведение при эпилепсии. Сборник материалов Конференции ≪Эпилептология в медицине ХХI века≫ (Москва — Казань 6—10 апреля 2009 г.). Под ред. Е.И. Гусева, А.Б. Гехт. М 2009;199—201.
- Рудакова И.Г., Морозова О.С., Котов А.С. и др. Влияние современных антиэпилептических препаратов на качество жизни больных эпилепсией. Журн неврол и психиат (Эпилепсия) 2008; 3: 36—40.
- Johannessen S.I., Landmark C.J. Value of therapeutic drug monitoring in epilepsy. Expert.Rev.Neurother. 2008, 8(6), 929-939.
- Описание препарата. www.vidal.ru
Источник
Данная информация не может использоваться при самолечении!
Обязательно необходима консультация со специалистом!
Зачем нужно исследовать концентрацию противосудорожных препаратов в крови?
Противосудорожные препараты используют для лечения такой серьезной патологии, как эпилепсия. Заболевание это, к сожалению, не поддается полному излечению, и пациент вынужден пожизненно принимать лекарства, препятствующие возникновению судорог. Противосудорожный эффект обеспечивается постоянной концентрацией лекарства в крови пациента.
Основанием для расчета дозы лекарства служит вес пациента, но ученые установили, что даже у людей с одинаковым весом активная концентрация препарата в крови существенно отличается. Объясняется это индивидуальными особенностями метаболизма лекарственного средства. Поэтому для более качественного лечения врачи ориентируются на содержание препарата в крови.
Кто назначает эти исследования, где сдают анализы?
Определение концентрации противоэпилептического препарата в крови может назначить врач-невролог или эпилептолог. Если пациент попал в больницу с судорожным синдромом, назначение анализа может сделать реаниматолог. При плановом обращении кровь на анализ сдают в лаборатории, в случае госпитализации – в стационаре.
Показания для исследования крови на противосудорожные препараты, подготовка к анализу
Самые часто используемые при эпилепсии лекарства – вальпроевая кислота, карбамазепин, фенитоин, производные барбитуровой кислоты (фенобарбитал). Показания для исследования крови на эти вещества в целом схожи. Исследование показано при необходимости изменения дозы принимаемого препарата и при недостаточной эффективности назначенной дозировки.
Определение концентрации противосудорожных средств назначают при переходе на другую схему лечения или, например, при добавлении к получаемой терапии нового препарата, а также при замене одного средства на другое. Выраженные побочные эффекты одного из лекарств, появление признаков поражения почек или печени служат основанием для назначения исследования.
Признаки острого отравления противосудорожным препаратом являются показанием для экстренного проведения анализа. Симптомы отравления следующие: резкое угнетение сознания, повышенная сонливость, частичная дезориентация пациента.
Специально готовиться к исследованию не нужно, кровь берут натощак. Точные условия взятия анализа сообщает лечащий врач. Возможно, потребуется проведение пробы дважды – перед приемом лекарства и после него.
Как часто следует контролировать уровень противосудорожных препаратов в крови?
Содержание противоэпилептических препаратов в крови при спокойном течении заболевания проводят 1–2 раза в год. При изменении дозирования препарата анализ назначают через 2–4 недели после коррекции дозы. У беременных пациенток на протяжении всей беременности контроль осуществляют каждые 2–3 недели.
Целевые уровни противосудорожных препаратов, интерпретация результатов анализа
Требуемый противосудорожный эффект достигается при следующих целевых концентрациях препаратов в плазме крови: вальпроевая кислота – 50–100 мкг/мл, карбамазепин – 4–13 мкг/мл, фенитоин – от 10 до 20 мкг/мл, фенобарбитал – от 10 до 40 мкг/мл.
Превышение этих значений свидетельствует о неправильно подобранной дозе, при которой токсические эффекты препаратов будут очень заметны, или об отравлении препаратом. В этом случае врач уменьшит дозу, а при неэффективности препарата – произведет его замену.
Низкое значение показателя свидетельствует о неадекватной дозировке лекарства, повышенном его выведении или несоблюдении пациентом режима приема. В этом случае может отмечаться учащение судорожных припадков. И тогда врач проведет коррекцию лечения – увеличит дозу или назначит дополнительно еще одно средство.
Источник
 Применение лекарственных средств зачастую связано с риском развития нежелательных лекарственных реакций. С целью их предотвращения для большинства известных нам препаратов фармакологи и клиницисты определяют допустимые границы дозирования, в которых лекарство реализует преимущественно полезные свойства, а токсические эффекты напротив – не проявляет. Однако процессы выведения препаратов из организма сильно варьируют у разных пациентов. Индивидуальные отличия в фармакологическом эффекте связаны преимущественно с тем, что к реализации полезного действия препарата имеет отношение в большей степени концентрация лекарственного вещества в крови, нежели его доза. Нередко, при назначении препарата в стандартной дозе его концентрационные значения в крови так и не достигают терапевтического концентрационного уровня, вследствие чего у пациента не происходит ожидаемого полезного действия лекарства. Обратная картина наблюдается при чрезмерном накоплении лекарственного вещества в крови, что может приводить к развитию токсического эффекта препарата и сопровождаться многочисленными нежелательными лекарственными реакциями.
Применение лекарственных средств зачастую связано с риском развития нежелательных лекарственных реакций. С целью их предотвращения для большинства известных нам препаратов фармакологи и клиницисты определяют допустимые границы дозирования, в которых лекарство реализует преимущественно полезные свойства, а токсические эффекты напротив – не проявляет. Однако процессы выведения препаратов из организма сильно варьируют у разных пациентов. Индивидуальные отличия в фармакологическом эффекте связаны преимущественно с тем, что к реализации полезного действия препарата имеет отношение в большей степени концентрация лекарственного вещества в крови, нежели его доза. Нередко, при назначении препарата в стандартной дозе его концентрационные значения в крови так и не достигают терапевтического концентрационного уровня, вследствие чего у пациента не происходит ожидаемого полезного действия лекарства. Обратная картина наблюдается при чрезмерном накоплении лекарственного вещества в крови, что может приводить к развитию токсического эффекта препарата и сопровождаться многочисленными нежелательными лекарственными реакциями.
Для преодоления этих проблем был разработан достаточно универсальный клинический подход, под названием терапевтический лекарственный мониторинг — комплекс мероприятий по определению концентрации лекарственных веществ в физиологических жидкостях пациентов, с целью подбора оптимальной схемы дозирования, наиболее эффективной для конкретного пациента, и минимизации нежелательных побочных эффектов лекарственного препарата.
Главная цель лекарственного мониторинга – фармакокинетический контроль лекарственной терапии. Согласно приказа № 4.94 МЗ РФ от 22.10.2003 г противоэпилептические препараты (антиконвульсанты) были отнесены к перечню препаратов, применение которых следует в обязательном порядке сочетать с мониторингом их концентрации в крови. Персонализация терапии эпилепсии – современная стратегия ведения таких пациентов, которая подразумевает выбор лекарственного препарата в зависимости от индивидуальных параметров больного и особенностей фармакодинамики и фармакокинетики противоэпилептических средств.
Международная противоэпилептическая лига в 2008 г. сформулировала некоторые общие показания для проведения терапевтического лекарственного мониторинга при использовании противоэпилептических препаратов:
- Применение при впервые установленной эпилепсии (определение концентрационных значений верхней и нижней границы терапевтического коридора),
- Определение постиктального концентрационного уровня противоэпилептического препарата в плазме крови,
- При выраженных побочных эффектах (определение индивидуального «терапевтического диапазона» пациента и вместе с тем определение «индивидуального токсического порога», оценка индивидуального прогноза лечения)
- Сопровождение процесса отмены лекарственного препарата
- Для определения приверженности лечению (комплаентности)
- Для оптимизации режима дозирования у детей в период фазы роста или у пациентов с резко изменившимся, в силу различных причин, весом
- При колебании стационарной концентрации антиконвульсантов на фоне приема оральных контрацептивов
- При межлекарственных взаимодействиях
- Отсутствие терапевтического эффекта или неудовлетворительный эффект при стандартной терапевтической дозе,
- Выраженные побочные эффекты при стандартной терапевтической дозе препарата,
- При срыве ремиссии без изменения дозы,
- Индивидуальные генетические особенности
- Предполагаемые изменения фармакокинетики, например, у больных пожилого возраста, при риске межлекарственных взаимодействий, беременности;
- Замена противоэпилептического препарата на другую лекарственную форму, или на дженерик;
Существует отработанный метод взятия крови для лекарственного мониторинга под названием стратегия «пик-спад». По этой схеме кровь отбирают двукратно. Первый раз кровь забирают натощак, до приема препарата, во время максимального снижения его стационарной концентрации в крови, непосредственно перед очередным введением препарата. Считается, что остаточный уровень препарата отображает терапевтическую эффективность лекарственного средства. Второй отбор производится на концентрационном максимуме препарата, который измеряют как правило спустя 2-3 часа после перорального введения, спустя 1 час после внутримышечной инъекции и через 30 мин после внутривенного введения препарата. Предполагается, что по концентрации после приема можно судить о возможных токсических эффектах препарата.
В ФГБНУ «Научный центр неврологии» проводится терапевтический лекарственный мониторинг большинства противоэпилептических препаратов, применяемых в Российской Федерации. При необходимости, интерпретация данных лекарственного мониторинга и адекватная индивидуализация режима дозирования может быть осуществлена с привлечением высококвалифицированных врачей-эпилептологов Центра.
Ниже приведен перечень препаратов, для которых осуществляется процедура лекарственного мониторинга на базе ФГБНУ «Научный центр неврологии» с указанием цены за один анализ:
Терапевтический лекарственный мониторинг | Цена |
| Карбамазепин | 1000 |
| Ламотриджин | 1000 |
| Топирамат | 1000 |
| Леветирацетам | 1000 |
| 1000 | |
| Вальпроевая кислота (анализ одного образца) | 1000 |
| Фенобарбитал (анализ одного образца) | 1000 |
| Этосуксимид (анализ одного образца) | 1000 |
Зонисамид (анализ одного образца) | 1000 |
| Окскарбазепин по его активному метаболиту (анализ одного образца) | 1000 |
| Два противоэпилептических препарата (при политерапии) из списка: Карбамазепин/ Ламотриджин/ Топирамат/ Леветирацетам/ Вальпроевой кислоты/ Фенитоина/ Фенобарбитала/ Этосуксимида/ Зонисамида/Окскарбазепина по его активному метаболиту. | 1750 |
| Три противоэпилептических препарата (при политерапии) из списка: Карбамазепин/ Ламотриджин/ Топирамат/ Леветирацетам/ Вальпроевой кислоты/ Фенитоина/ Фенобарбитала/ Этосуксимида/ Зонисамида/Окскарбазепина по его активному метаболиту. | 2750 |
Все исследования осуществляются на современном поверенном хроматографическом и хроматомасс-спектрометрическом оборудовании. Используемые методы количественного анализа метрологически валидированны согласно рекомендациям «Руководства по экспертизе лекарственных средств МЗ РФ» и международному руководству «Guideline on bioanalytical method validation» Европейского агентства лекарственных средств (EMEA).
Источник
