Анализ крови на болезнь гофмана

Спинальная амиотрофия представляет собой прогрессирующее нервно-мышечное заболевание, имеющее несколько форм течения. Болезнь передается по наследству.
При этой патологии страдает проксимальная поперечнополосатая мускулатура – преимущественно, нижних конечностей, туловища и шеи. Чувствительность в пораженных областях сохранена, интеллектуальное и психическое развитие не нарушены.
Самые тяжелые формы болезни с неблагоприятным прогнозом отмечаются при манифестировании болезни в детском возрасте.
Общие сведения
Свое название в виде «синдрома Верднига-Гоффмана» спинальная мышечная атрофия (СМА) получила благодаря ученым-неврологам G. Werdnig и J. Hoffmann. Они описали основные проявления болезни у детей еще в конце XIX столетия. В связи с особенностями русской транскрипции фамилии второго автора, можно встретить и другие названия этого синдрома в отечественной литературе: Верднига-Гофмана или -Хоффмана.
В середине XX столетия Е. Kugelberg и L. Welander описали поздние формы СМА, которые имеют такое же происхождение, что и детские, но их течение более доброкачественное. Поэтому иногда поздние формы спинальной амиотрофии (третий и четвертый тип) называют синдромом Кугельберга-Вилландера.
Причины появления СМА
Болезнь развивается в результате поражения двигательных (моторных) нейронов, находящихся в передних рогах спинного мозга, вплоть до полного их исчезновения. Последствием этого является нарушение иннервации проксимальных мышечных волокон, что приводит к прогрессирующей их слабости, развитию атрофии и невозможности совершать движения.
Причиной такого разрушения является дефицит специального белка, за синтез которого отвечает ген SMN (survival motor neuron gene). Локализация этого гена находится в пятой хромосоме. Генетически обусловленная мутация гена SMN, собственно, и вызывает развитие этой патологии.
Болезнь Верднига-Гофмана относится к аутосомно-рецессивному типу наследования. Это значит, что аномальный ген должен присутствовать у обоих родителей, которые при этом могут не иметь внешних признаков заболевания. При этом риск рождения больного ребенка у такой пары составляет 25%. В остальных случаях рождаются абсолютно здоровые дети.
Статистика и факты о СМА:
- Один ребенок из 6000–10000 новорожденных будет иметь признаки спинальной амиотрофии.
- Рецессивный ген, «ответственный» за развитие заболевания, выявляется примерно у каждого 50-го человека.
- Спинальная амиотрофия является одной из распространенных генетических нарушений, хотя встречается относительно редко.
- Проявления болезни могут манифестировать в любом возрасте.
- Половина заболевших детей не доживают до двухлетнего возраста.
Помимо этой патологии, существуют также виды спинальной амиотрофии с аутосомно-доминантным или сцепленным с Х-хромосомой типом наследования. Однако, для них характерны мутации других генов и, соответственно, иные признаки.
Типы болезни
В классификации синдрома Верднига-Гоффмана выделяют четыре типа течения болезни. В основу такого подразделения положены следующие критерии:
- Возраст начала заболевания (манифестации).
- Тяжесть течения.
- Продолжительность жизни.
По мнению многих исследователей, именно к синдрому Верднига-Гофмана относятся только первый и второй типы спинальной амиотрофии. Но, учитывая отсутствие общепринятой классификации, мы будем рассматривать проявления всех типов этой болезни.
Отмечено, что «толчком» к началу дебюта всех типов СМА нередко служит перенесенное инфекционное заболевание, травма, проведенная вакцинация или другой внешний фактор.
Первый тип
Такая форма синдрома Верднига-Гофмана манифестирует в возрасте до 6 месяцев жизни ребенка. Первый тип СМА отличается самым злокачественным и быстропрогрессирующим течением.
Иногда заболевание начинает развиваться еще во внутриутробном периоде. В таком случае диагностируется низкая активность плода, вялые и редкие шевеления. Если дебют спинальной амиотрофии произошел позже, то такие дети могут нормально держать голову и даже пытаться переворачиваться. Правда, эти умения быстро утрачиваются.
Общие симптомы для первого типа СМА:
- Быстрое развитие общей мышечной гипотонии. Для ребенка характерна поза «лягушки»: безвольное отведение ног и рук с согнутыми коленными и локтевыми суставами. Сухожильные рефлексы отсутствуют.
- Нарушены сосательные и глотательные функции, затруднены движения языка.
- Крик таких детей слабый.
- Поражение межреберных и диафрагмальных мышц вызывают проблемы с актом дыхания с развитием дыхательной недостаточности.
- Часто развиваются деформации грудной клетки.
Нередко врожденная спинальная амиотрофия первого типа сочетается с аномалиями развития. Наиболее часто выявляется микроцефалия, косолапость, крипторхизм у мальчиков, миопатии, врожденные переломы и т. д.
Часто смерть таких детей наступает от осложненной пневмонии (аспирационной или инфекционной) и сопутствующей прогрессирующей дыхательной недостаточности.
Дети с врожденной формой СМА первого типа редко доживают до 12 месяцев жизни. При более поздней манифестации этой формы заболевания продолжительность жизни составляет обычно два-три года.
Второй тип
Признаки синдрома Верднига-Гофмана в этом случае впервые появляются в возрасте 6–18 месяцев жизни ребенка. До начала дебюта заболевания ребенок ничем не отличается от здоровых сверстников. Такие дети нормально держат голову, умеют ползать, сидеть и даже стоять. Однако, в большинстве случаев, научиться ходить они так и не успевают.
Характерные симптомы второго типа СМА:
- Быстрый регресс полученных навыков – ползания, сидения, стояния и т. д. Ребенок перестает стоять, затем – сидеть, ползать и переворачиваться.
- Типично распространение мышечной слабости начиная с нижних конечностей вверх, с развитием вялых парезов.
- Верхние конечности обычно поражаются позже.
- Вследствие поражения мышц шеи ребенок плохо удерживает голову в вертикальном положении.
- Характерными являются миофасцикуляции (непроизвольные подергивания мышечных пучков). Чаще они возникают в кистях, языке, мышцах плечевого и тазового поясов.
- Тремор (дрожание) рук.
- Нередко возникает контрактура (неподвижность) суставов и позвоночного столба, обусловленная мышечной гипотонией и атрофией.
- Позже возникают признаки бульбарного паралича. При этом у таких детей нарушается произношение звуков вплоть до полной афонии. Происходят расстройства акта глотания: больные поперхиваются даже жидкой пищей или не могут проглотить еду и жидкость.
Продолжительность жизни больных со вторым типом СМА составляет приблизительно 10–14 лет. Смерть обычно наступает вследствие глубоких расстройств ритма дыхания и сердечной деятельности.
Причиной летального исхода достаточно часто также является пневмония.
Третий и четвертый тип
Спинальная амиотрофия в этом случае манифестирует в достаточно широком возрастном диапазоне: от 1,5–2 до 20 и старше лет. При этом дети уже овладевают основными двигательными навыками и умеют сидеть, стоять, ходить и бегать. Заболевание развивается постепенно и начинается часто незаметно.
Для такого типа спинальной амиотрофии характерно медленное развитие патологических симптомов, которое занимает иногда достаточно длительное время. Способность больных к самостоятельному передвижению и самообслуживанию сохраняется 8–10 и более лет от дебюта заболевания.
Признаки поздней формы СМА:
- Мышечная слабость начинает развиваться с проксимальных отделов нижних конечностей. Такие дети быстро устают при ходьбе, спотыкаются, плохо бегают.
- С прогрессированием болезни возникает характерная походка, со сгибанием ног в коленных суставах («заводной куклы»).
- Со временем развиваются вялые парезы и параличи нижних конечностей, что обуславливает неспособность больного к самостоятельному передвижению.
- Постепенно поражаются мышцы туловища, шеи и верхних конечностей.
- При вовлечении в патологический процесс бульбарного отдела возникают расстройства речи и функции глотания.
- Мышечная атрофия достаточно долго не выявляется визуально, вследствие хорошо выраженного подкожно-жирового слоя. Нарастание ее интенсивности сопровождается угнетением сухожильных рефлексов и формированием суставных контрактур.
- Также могут формироваться различные деформации костей и суставов. Помимо суставных контрактур, наиболее часто встречаются гиперлордоз поясничного отдела позвоночника и воронкообразный вид грудной клетки.
- Продолжительность жизни больных с третьим типом СМА составляет более 20 лет от начала дебюта заболевания.
Иногда выделяют четвертый тип СМА, при котором заболевание манифестирует в возрасте после 30 лет. Характеризуется постепенным и медленным нарастанием слабости и атрофическими изменениями мышц нижних конечностей, что в итоге приводит к инвалидности. Дыхательная мускулатура в патологический процесс обычно не вовлекается.
Это самый доброкачественный тип течения спинальной амиотрофии. Продолжительность жизни таких больных практически такая же, как и у здоровых людей.
Диагностика
Проявления проксимальной спинальной амиотрофии часто напоминают течение других неврологических и врожденных заболеваний, а также травматических повреждений структур спинного и головного мозга. Особенно затруднена диагностика этого заболевания у новорожденных и детей раннего возраста.
Ключевыми моментами в диагностике спинальной амиотрофии являются следующие исследования:
- Тщательный сбор анамнеза. Наличие случаев спинальной амиотрофии у родственников позволяет заподозрить это наследственное заболевание.
- Электронейромиография – специальное исследование нервно-мышечного аппарата. При этом исключается первичное поражение мышц и выявляются признаки, указывающие на патологию двигательных нейронов спинного мозга.
- Компьютерная и магнитно-резонансная томография. Эти методы позволяют иногда выявить атрофические изменения передних рогов спинного мозга. Однако, чаще они применяются для исключения другой патологии со стороны структур позвоночного столба и головного мозга.
- Биопсия мышц и с последующим гистологическим исследованием биоптата. Выявляются специфические изменения мышц, заключающиеся в чередовании пучковых атрофических и неизмененных мышечных волокон. Помимо этого, могут выявляться и компенсаторно гипертрофированные участки мышц, а также замещение мышечной ткани соединительной.
- Генетический анализ. Позволяет выявить точную причину заболевания: при исследовании ДНК выявляется мутация гена в пятой хромосоме.
Если в семье были случаи рождения детей со спинальной амиотрофией, при планировании последующей беременности супружеская пара направляется на консультацию к генетику. Также обязательной является дородовый анализ ДНК плода. Выявление синдрома Верднига-Гоффмана на стадии пренатальной диагностики служит показанием к прерыванию беременности.
Лечение
Учитывая наследственный генез, радикального лечения спинальной амиотрофии все еще не существует. Следовательно, эта патология считается неизлечимой.
На сегодняшний день таким больным проводится в основном симптоматическое лечение, направленное на поддержание функционирования мышечных волокон, а также – борьбу с осложнениями.
Основные принципы поддерживающей терапии при СМА:
- Специальное диетическое питание.
- Умеренные занятия лечебной физкультурой.
- Массаж.
- Некоторые физиотерапевтические методы (оксигенотерапия, ванны и т. д.).
- Ортопедические воздействия для предупреждения контрактур суставов.
- Медикаментозные препараты, улучшающие нервно-мышечную проводимость и питание мышц. Также назначаются средства, влияющие на метаболизм центральной нервной системы и микроциркуляцию.
При развитии дыхательной недостаточности, часто сопровождающей течение болезни (особенно, при первом и втором типе СМА), применяют различные методы вспомогательной или искусственной вентиляции легких. При выраженных нарушениях глотания может применяться гастростомическая питательная трубка. Многие больные с СМА вынуждены передвигаться с помощью инвалидных колясок.
В настоящее время ведутся научные исследования, направленные на создание препарата, увеличивающего синтез белка SMN, недостаточный уровень которого является причиной разрушения мотонейронов спинного мозга.
Источник: MoySkelet.ru
Читайте также
Вид:


Источник
Причины заболевания

Многие годы пытаетесь вылечить СУСТАВЫ?
Глава Института лечения суставов: «Вы будете поражены, насколько просто можно вылечить суставы принимая каждый день средство за 147 рублей…
Читать далее »
Основной причиной спинальной амиотрофии Верднига Гоффмана является мутация гена SMN (от англ. survival motor neuron). Располагается ген выживания мотонейрона на 5 хромосоме, представлен двумя копиями:
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения суставов наши читатели успешно используют Sustalaif. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
- SMNt — теломерная копия, функционально активная;
- SMNc — центромерная копия гена, частично активная.
Продуктом этого гена является белок SMN, участвующий в образовании и регенерации РНК.
Нехватка белка вызывает патологии двигательного нейрона.
В 95% случаев болезни Верднига-Гофмана наблюдается делеция (выпадение) SMNt, что вызывает дефицит белка SMN. Копия SMNc лишь частично компенсирует отсутствие теломерной копии.
Количество копий SMNc составляет от 1 до 5. Чем больше число центромерных копий, тем полнее воспроизводится белок и менее выражена патология нейрона.
Кроме количества копий SMNc, тяжесть заболевания определяется длиной участка делеции и генными конверсиями еще 3 генов: NAIP, H4F5, GTF2H2. Участием дополнительных модифицирующих факторов объясняется клиническое разнообразие симптомов.
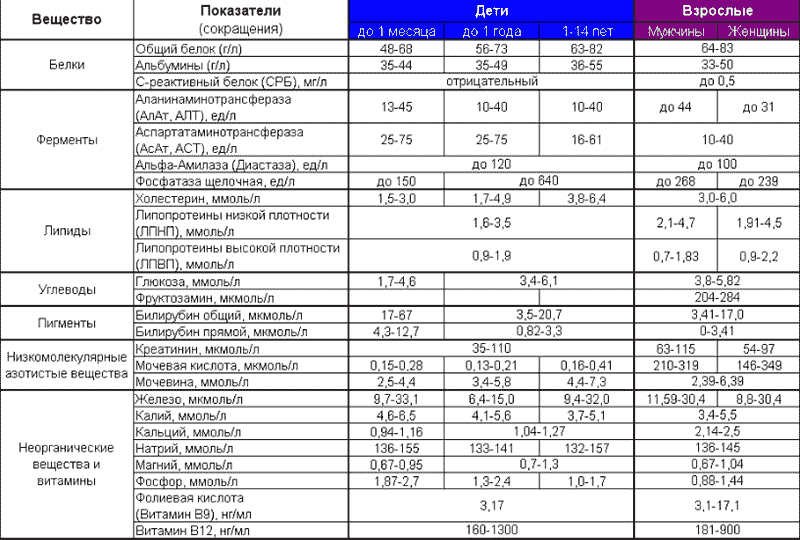
Подготовка к анализу на биохимию: как не исказить результаты
Для анализа на биохимию используют венозную кровь, около 5 мл, распределяемых по нескольким пробиркам. Так как в исследование входят показатели, способные изменяться из-за поступления пищи, воды, физической активности или нервно-эмоционального возбуждения, а также из-за приема некоторых медикаментов, существуют правила подготовки к сдаче крови для исследования. К ним относят:
- голод в течение 10-12 часов до забора крови;
- исключение из рациона во второй половине предшествующего анализу дня кофе, крепко заваренного чая;
- щадящая диета в течение 2-3 дней перед анализами: желательно не употреблять жирную, жареную, острую пищу, алкоголь и т. д.;
- в течение предыдущих суток необходимо избегать высокой физической активности и тепловых процедур (баня, сауна, длительная горячая ванна);
- сдавать кровь необходимо до приема ежедневных медикаментов, проведения дополнительных медицинских процедур и манипуляций (инъекций, внутривенного введения препаратов, исследований физическими методами – рентгенографии, флюорографии и т. п., посещения стоматолога);
- в день забора крови необходимо воздержаться от физической активности, утренней пробежки или длительной прогулки пешком до лаборатории. Любая двигательная активность влияет на картину крови и затрудняет интерпретацию результатов;
- стрессы, нервное напряжение, так как эмоциональное возбуждение также может искажать результаты;
- непосредственно перед анализом необходимо спокойно посидеть в течение 10 минут и убедиться, что ритм дыхания и сердцебиения в норме;
- для точных показателей анализа на глюкозу, одного из определяемых при биохимии факторов, особенно важного при диагностике диабета, надо воздерживаться не только от утренних напитков (в том числе воды) и жевательной резинки, но и от чистки зубов, особенно с зубной пастой. Вкусовые рецепторы способствуют активизации работы поджелудочной железы и выработке инсулина;
- за сутки до анализа не рекомендуется принимать лекарственные препараты гормонального, мочегонного, антибактериального, тромборассасывающего действия, медикаменты, влияющие на вязкость крови и т. п.;
- при необходимости в диагностике количества холестерина в крови на фоне приема статинов курс терапии (по согласованию со специалистом) необходимо прекратить за 10-14 дней;
- если требуется повторное исследование для уточнения результатов, забор крови должен производиться с максимально схожими условиями: та же лаборатория, время суток, вплоть до маршрута от дома до места забора крови (пешком или на транспорте).
Источник
Проксимальная спинальная амиотрофия I, II, III, IV типа (САМ I-IV) — одно из наиболее частых наследственных заболеваний с аутосомно-рецессивным типом наследования, с частотой встречаемости 1 на 6000-10000 новорожденных. Основной механизм развития клинических признаков связан с прогрессирующей дегенерацией мотонейронов передних рогов спинного мозга, что выражается в атрофии проксимальных мышц конечностей, в первую очередь. Выделяют четыре формы проксимальной спинальной амиотрофии на основе возраста начала, тяжести течения и продолжительности жизни.
Спинальная амиотрофия I типа (СAМ I, болезнь Верднига-Гоффмана, OMIM 253300) — наиболее тяжелая форма, первые симптомы можно нередко выявить еще во внутриутробном периоде по слабому шевелению плода. У значительного числа детей с болезнью Вердника-Гоффмана отчетливые клинические проявления отмечаются до 6-ти месячного возраста и характеризуются выраженными признаками вялого паралича мышц конечностей и туловища, с вовлечением в процесс дыхательной мускулатуры. Дети с болезнью Вердника-Гоффмана не держат голову, не сидят самостоятельно.
Спинальная амиотрофия II типа (СAМ II, промежуточная форма, OMIM 253550) имеет более позднее начало, как правило, после 6 месяцев. Больные этой формой спинальной амиотрофии дети могут сидеть, но никогда не достигают способности ходить самостоятельно.Прогноз в этих случаях зависит от степени вовлечения в патологический процесс респираторных мышц.
Спинальная амиотрофия III типа (СAМ III, болезнь Кюгельберга-Веландер, OMIM 253400) первые симптомы у пациентов появляются после 18 месяцев. При болезни Бюгельберга-Веландер больные могут стоять и ходить самостоятельно.
Кроме того, выделяют спинальную амиотрофию IV типа (САМ IV или взрослую форму) (OMIM 271150) – медленно прогрессирующее заболевание, имеющее начало в большинстве случаев после 35 лет, значительно не влияет на продолжительность жизни. Спинальная амиотрофия IV типа характеризуется слабостью проксимальной мускулатуры, фасцикуляциями, снижением сухожильных рефлексов, приводит к неспособности ходить самостоятельно.
Ген, ответственный за возникновение проксимальной спинальной амиотрофии I-IV типа, названный SMN (survival motor neuron gene), расположен в районе 5q13 и представлен двумя высокогомологичными копиями (теломерной — SMN1 или SMNt и центромерной — SMN2 или SMNc). У 96% пациентов с различными типами спинальной амиотрофии регистрируется делеция гена SMN1.
В Центре Молекулярной Генетики проводится прямая ДНК-диагностика спинальной амиотрофии. Прямая диагностика основана на аллель-специфичной лигазной реакции фрагментов экзонов 7 и 8 обоих генов, дающей возможность зарегистрировать наличие/отсутствие соответствующих экзонов генов SMN1 и SMN2. Проведение дородовой ДНК-диагностики спинальной амиотрофии снижает риск рождения больного ребенка практически до 0% .
Кроме того, в Центре Молекулярной Генетики осуществляется количественный анализ генов локуса 5q13 (локус СМА). Полуколичественные молекулярные методы диагностики спинальных мышечных атрофий позволяют определять не число копий генов на геном, а соотношение числа центромерных и теломерных копий гена, что не всегда информативно, т.к. данное соотношение может быть обусловлено как увеличением числа копий гена SMN2, так и снижением числа копий гена SMN1. Поэтому количественнный анализ, регистрирующий число генов локуса СМА, является незаменимым при определении статуса носителя спинальной амиотрофии, что имеет большое значение для семей, где материал больного ребенка недоступен, а также для здоровых членов семей САМ I-IV и вновь созданных супружеских пар, в которых один из супругов является облигатным носителем спинальной амиотрофии, для их дальнейшего медико-генетического консультирования.
Для лиц, соответствующих следующим критериям, в Центре Молекулярной Генетики возможно проведение поиска точковых мутаций в гене SMN1 методом прямого автоматического секвенирования:
- фенотип проксимальной спинальной мышечной атрофии I-IV типа;
- электромиографические признаки переднерогового поражения спинного мозга;
- отсутствие мажорной мутации в гене SMN1 – делеции экзонов 7 и/или 8 в гомозиготном состоянии;
- наличие одной копии гена SMN1, подтвержденное количественным молекулярно-генетическим методом.
Нами разработан набор для ДНК-диагностики спинальных амиотрофий I, II, III типов. Набор предназначен для использования в диагностических лабораториях молекулярно-генетического профиля.
При проведении пренатальной (дородовой) ДНК-диагностики в отношении конкретного заболевания, имеет смысл на уже имеющемся плодном материале провести диагностику частых анеуплоидий (синдромы Дауна, Эдвардса, Шерешевского-Тернера и др), пункт 54.1. Актуальность данного исследования обусловлена высокой суммарной частотой анеуплоидий — около 1 на 300 новорожденных, и отсутствием необходимости повторного забора плодного материала.
Публикации по теме раздела
Спинальная амиотрофия типы I, II, III, IV
Источник: www.dnalab.ru
Читайте также
Вид:


Источник