Анализ крови на амилоидные белки
Специалисты из Австралии и Японии придумали, как по анализу крови выявить у людей начало болезни Альцгеймера. Тест определяет, в чьём мозге высокое содержание бета-амилоида — белка, который является ключевым игроком в болезни Альцгеймера и способен вызвать деменцию.
Авторы работы надеются, что разработчики лекарств смогут использовать тест, чтобы выявлять людей с деменцией для клинических испытаний до того, как будет нанесён необратимый ущерб их мозгу. Собственно, благодаря этому испытания любых препаратов будут более надёжными.
Молекулярный биолог Кацухико Янагисава (Katsuhiko Yanagisawa) и его коллеги из Центра развития передовой медицины для лечения деменции (Япония) создали прототип теста на биомаркер.
Чтобы измерить содержание белка, указывающего на деменцию, Янагисава и его коллеги соединили две известные методики: иммунопреципитацию и масс-спектроскопию. Результаты их тестов совпадали с результатами, полученными при помощи визуализации головного мозга и анализа спинномозговой жидкости (два основных теста, выявляющих признаки болезни) в двух отдельных группах, включающих 121 человека из Японии и 252 людей из Австралии.
В каждую группу входили люди в возрасте от 60 до 90 лет. Некоторые из участников были здоровы, некоторые показывали лёгкие нарушения когнитивных навыков, а третьим уже был поставлен диагноз болезнь Альцгеймера.
По словам авторов работы, по небольшому образцу крови их метод может измерить количество нескольких белков, связанных с амилоидами, даже если концентрация первых очень низка. Японцы обнаружили, что определённое соотношение этих белков было точным биомаркером деменции.
К слову, исследователи всего мира искали простой анализ крови на деменцию в течение последних 15 лет. «Сначала не было очевидно, что патология мозга может быть измеримой в крови, но постепенно мы всё больше приближались к решению», — говорит нейробиолог Саймон Лавстоун (Simon Lovestone) из Университета Оксфорда. Он возглавлял другие исследования, направленные на поиск биомаркеров крови для болезни Альцгеймера (ранее мы рассказывали о результатах работы его команды). «Эта же статья предоставляет лучшие результаты, из того что я когда-то видел», — признаёт учёный.
На сегодняшний день все потенциальные лекарства, предназначенные для приостановки развития болезни Альцгеймера, до сих пор не прошли клинические испытания. Многие фармацевтические компании и вовсе перестали работать в этом направлении. Нынешнее открытие может изменить ситуацию.
Ранее учёные предполагали, что провести такие клинические испытания невозможно. Ведь до сих пор не было никакого надёжного способа выявлять людей с ранними стадиями деменции. Поэтому в большом количестве клинических испытаний участвовали пациенты, чьи симптомы уже были очевидны.
По словам Янагисавы, если повреждение мозга, связанное с бета-амилоидами, уже имеет место, то, возможно, уже слишком поздно пытаться обратить симптомы заболевания. Иными словами, исследователям нужен был метод ранней диагностики.
Единственные способы выявления бета-амилоидов в мозге (помимо вскрытия) сегодня – это визуализация мозга при помощи позитронно-эмиссионной томографии или измерение уровня белка прямо в спинномозговой жидкости из спинного мозга. Обе процедуры использовались для выявления потенциальных участников испытаний, но процедуры стоят дорого и довольно неприятны для пациентов. Новый тест может решить обе проблемы.
Если эффективность теста подтвердиться дальнейшими исследованиями, то он станет тем самым долгожданным анализом, который поможет также в поиске терапии, способной остановить прогрессирование деменции (слабоумия). К сожалению, этот недуг портит жизни десятков миллионов людей по всему миру.
Авторы говорят, что необходимы более крупные исследования, чтобы подтвердить точность их анализа при выявлении высоких уровней бета-амилоидов в мозге человека.
Результаты исследования и описание нового теста представлены в издании Nature.
Ранее авторы «Вести.Наука» (nauka.vesti.ru) сообщали о том, что спрогнозировать появление этой болезни заранее можно с помощью виртуальной реальности. Также первыми признаками болезни Альцгеймера назвали тревожность и депрессию.
Источник

Амилоидные бляшки в мозге пациента с болезнью Альцгеймера (бляшки на изображении напоминают соцветия лука)
KGH / Wikimedia Commons
Ученые нашли способ диагностировать раннюю стадию болезни Альцгеймера по анализу крови. Исследователи продемонстрировали в статье в Nature, что соотношение
фрагментов разных типов бета-амилоида в плазме крови коррелирует со степенью нейродегенерации и выраженности когнитивных
нарушений пациентов.
Патогенез болезни Альцгеймера определяется постепенным накоплением
в мозге агрегатов бета-амилоидного белка (Aβ), которое со временем приводит к деградации нервной ткани.
Накопление бета-амилоида можно зарегистрировать задолго до того, как у человека
начнет проявляться основной симптом болезни — когнитивные нарушения и деменция.
Так как современные способы терапии могут только затормозить
наступление деменции, но не обратить ее, людям, входящим в группу риска
(например, с генетической предрасположенностью к развитию заболевания) имело бы
смысл, начиная с определенного возраста, проходить профилактические обследования.
Однако простых и дешевых тестов для выявления патологических процессов в мозге
в настоящее время нет. Самые надежные способы диагностики накопления амилоидных
бляшек на сегодняшний день это позитронно-эмиссионная томография мозга (ПЭТ) и анализ
спинно-мозговой жидкости на наличие фрагментов бета-амилоида.
Японские исследователи совместно с коллегами из Австралии разработали
тест, который позволяет детектировать фрагменты бета-амилоида в плазме крови, и
проверили его на двух выборках пациентов с заболеванием на разной стадии.
Предыдущие попытки выявить в плазме бета-амилоид при помощи стандартного метода
ELISA были безуспешны,
однако авторы работы использовали иммунопреципитацию (осаждение антителами) с
последующей MALDI-TOF масс-спектрометрией
для количественного определения соотношения разных фрагментов амилоидного белка.
Оказалось, что эти соотношения служат хорошими биомаркерами накопления бета-амилоида
в мозге.
Условия диагностики ученые оптимизировали на выборке из 121
пациента отделения исследования деменции Национального центра гериатрии и
геронтологии в Японии и выборке участников национального австралийского
исследования биомаркеров старения (AIBL), куда вошло 252 человека. Возраст участников составлял от 60
до 90 лет, они делились на три группы — люди без когнитивных нарушений, с умеренными
нарушениями, и с выраженными когнитивными нарушениями.
Накопление амилоидных бляшек в мозге у пациентов сначала детектировали при помощи ПЭТ. Кроме того, для австралийской выборки были
доступны данные по анализу спинно-мозговой жидкости. Соотношение фрагментов
двух различных форм амилоидного белка в плазме крови достоверно коррелировало как
с данными биохимического анализа, так и с данными ПЭТ. Таким образом, анализ
крови надежно отражал состояние центральной нервной системы пациентов.
Тем не менее, авторы замечают, что перед масштабным
введением метода в клиническую практику требуется проделать еще много технической работы. В
частности, метод нужно проверить на участниках клинических испытаний препаратов
против болезни Альцгеймера, для того, чтобы понять, изменяется ли концентрация
биомаркеров в плазме в ходе терапии.
Ранее ученые предлагали использовать для ранней диагностики
болезни Альцгеймера лазерную офтальмоскопию, чтобы выявлять скопления бета-амилоида
в сетчатке глаза. А в эксперименте на модельных мышах исследователи показали,
что первые признаки заболевания сопровождаются изменением химического состава
мочи.
Дарья Спасская
Источник
Информация об исследовании
Белковые фракции представляют собой отдельные виды белков крови: альбумин, альфа1-, альфа2-, бета- и гамма-глобулины. Их исследование используется в качестве дополнительного теста в диагностике многих заболеваний.
Важное диагностическое значение имеют количественные взаимоотношения между отдельными белками сыворотки крови. Для разделения всех белков сыворотки используется метод электрофореза, основанный на различной подвижности белков сыворотки в электрическом поле.
С помощью электрофореза белки подразделяются на следующие фракции: альбумины и глобулиновые фракции (альфа1-глобулины, альфа2-глобулины, бета-глобулины и гамма-глобулины):
1. Альфа1-глобулины: альфа1-антитрипсин, альфа1-кислый гликопротеин, альфа-1 липопротеин.
2. Альфа2-глобулины: альфа2-макроглобулин, гаптоглобин, аполипопротеины, церулоплазмин.
3. Бета-глобулины: трансферрин, С3 компонент системы комплемента, бета-липопротеины, гемопексин.
4. Гамма-глобулины: иммуноглобулины — IgA, IgM, IgG.
В результате развития острых или обострения хронических воспалительных заболеваний соотношение белковых фракций изменяется.
Уменьшение количества того или иного вида белка наблюдается при иммунодефицитах, которые свидетельствуют о серьезных процессах в организме (аутоиммунные заболевания, ВИЧ, онкология и т.д.). Избыток того или иного вида белка свидетельствует о моноклональной гаммапатии (производство аномальных типов иммуноглобулинов). К последствиям гаммапатии можно отнести множественную миелому (рак плазматических клеток), макроглобулинемию Вальденстрема (опухоль костного мозга) и т.д.
Исследование белковых фракций является более информативным в диагностическом отношении, чем определение только общего белка или альбумина. При многих заболеваниях часто изменяется процентное соотношение белковых фракций, хотя общее содержание белка в сыворотке крови остаётся в пределах нормы.
При некоторых заболеваниях в крови появляются белки, отличающиеся в физическом, химическом и иммунологическом отношении от обычных белков сыворотки крови. Их называют моноклональными иммуноглобулинами (парапротеины, М-протеины). При проведении электрофореза белков сыворотки крови о наличии парапротеинов свидетельствует появление на электрофореграмме дополнительной (у здоровых людей отсутствует) узкой и резко ограниченной фракции белков (её ещё называют М-градиент) в области гамма-глобулинов.
Обнаружение парапротеинов наиболее характерно для парапротеинемических гемобластозов (миеломная болезнь, макроглобулинемия Вальденстрема, болезнь тяжёлых цепей), реже встречается при хронических гепатитах, у некоторых пациентов престарелого возраста. Имитировать М-белок могут высокие концентрации С-реактивного белка и фибриногена.
Повышение альфа-1- и альфа-2-глобулинов может наблюдаться при острых и обострениях хронических воспалительных процессов, при диффузных заболеваниях соединительной ткани (системная красная волчанка, ревматизм, ревматоидный артрит и др.), злокачественных опухолях, некоторых болезнях почек, протекающих с нефротическим синдромом (гломерулонефрит, амилоидоз и др.).
Снижение уровня альфа-2-глобулинов может наблюдаться при хроническом панкреатите, сахарном диабете, реже при токсических гепатитах. Повышение содержания бета-глобулинов чаще всего встречается у людей с нарушением липидного (жирового) обмена, в том числе у пациентов с атеросклерозом, ишемической болезнью сердца, гипертонией.
Снижение бета-глобулинов встречается реже и обычно обусловлено общим дефицитом белков плазмы.
Повышение количества гамма-глобулинов, являющихся основными «поставщиками» антител, нередко наблюдается при хронических заболеваниях печени (хронический гепатит, цирроз), хронических инфекциях, некоторых аутоиммунных заболеваниях (ревматоидный артрит, хронический аутоиммунный гепатит и др.), миеломной болезни.
Снижение гамма-глобулинов в крови встречается в норме у детей в возрасте 3-4 месяцев (физиологическое снижение), а у взрослых всегда имеет патологический характер и обычно указывает на врожденные или приобретенные иммунодефицитные состояния, нередко наблюдается при системной красной волчанке.
Показания к назначению исследования
1. Множественная миелома;
2. Макроглобулинемия Вальденстрема;
3. Гипогаммаглобулинемия;
4. Агамма-А-глобулинемия;
5. Анальбуминемия;
6. Нарушение обмена альфа-антитрипсина;
7. Цирроз печени;
8. Обследование пациентов с острыми и хроническими инфекциями
Подготовка к исследованию
Специальной подготовки к исследованию не требуется. Необходимо следовать общим требованиям подготовки к исследованиям.
ОБЩИЕ ПРАВИЛА:
1. Для большинства исследований кровь рекомендуется сдавать утром, в период с 8 до 11 часов, натощак (между последним приемом пищи и взятием крови должно пройти не менее 8-ми часов, воду можно пить в обычном режиме), накануне исследования легкий ужин с ограничением приема жирной пищи. Для тестов на инфекции и экстренных исследований допустимо сдавать кровь через 4-6 часов после последнего приема пищи.
2. ВНИМАНИЕ! Специальные правила подготовки для ряда тестов: строго натощак, после 12-14 часового голодания, следует сдавать кровь на гастрин-17, липидный профиль (холестерин общий, холестерин-ЛПВП, холестерин-ЛПНП, холестерин-ЛПОНП, триглицериды, липопротеин (а), аполипо-протен А1, аполипопротеин В); глюкозотолерантный тест выполняется утром натощак после 12-16 часов голодания.
3. Накануне исследования (в течение 24 часов) исключить алкоголь, интенсивные физические нагрузки, прием лекарственных препаратов (по согласованию с врачом).
4. За 1-2 часа до сдачи крови воздержаться от курения, не употреблять сок, чай, кофе, можно пить негазированную воду. Исключить физическое напряжение (бег, быстрый подъем по лестнице), эмоциональное возбуждение. За 15 минут до сдачи крови рекомендуется отдохнуть, успокоиться.
5. Не следует сдавать кровь для лабораторного исследования сразу после физиотерапевтических процедур, инструментального обследования, рентгенологического и ультразвукового исследований, массажа и других медицинских процедур.
6. При контроле лабораторных показателей в динамике рекомендуется проводить повторные исследования в одинаковых условиях – в одной лаборатории, сдавать кровь в одинаковое время суток и пр.
7. Кровь для исследований нужно сдавать до начала приема лекарственных препаратов или не ранее, чем через 10–14 дней после их отмены. Для оценки контроля эффективности лечения любыми препаратами нужно проводить исследование спустя 7–14 дней после последнего приема препарата.
Если Вы принимаете лекарства, обязательно предупредите об этом лечащего врача.
Факторы, влияющие на результаты исследований
Анаболические стероиды.
Интерпретация результата
Увеличение фракции альфа1-глобулинов:
1. Острые и хронические воспалительные процессы;
2. Патология печени;
3. Процессы тканевого распада;
Снижение фракции альфа1-глобулинов:
1. дефицит альфа1-антитрипсина;
2. гипо-альфа1-липопротеинемия;
Увеличение фракции альфа2-глобулинов:
1. Острые воспалительные процессы с экссудативным и гнойным характером (пневмония, эмпиема плевры);
2. Системные заболевания соединительной ткани (коллагонозы, аутоиммные процессы, ревматизм);
3. Злокачественные опухоли;
4. Нефротический синдром;
5. Стадия восстановления после термических ожогов;
Снижение фракции альфа2-глобулинов:
1. Сахарный диабет;
2. Панкреатит;
3. Врождённая механическая желтуха у новорождённых;
4. Токсический гепатит
Увеличение фракции бета-глобулинов:
1. Первичные и вторичные гиперлипопротеинемии.
2. Заболевания печени.
3. Нефротический синдром.
4. Кровоточащая язва желудка.
5. Гипотиреоз.
Снижение фракции бета-глобулинов:
1. гипобеталипопротеинемия.
Увеличение фракции гамма-глобулинов:
1. Вирусные и бактериальные инфекции.
2. Коллагенозы, ревматоидный артрит, системная красная волчанка.
3. Деструкция тканей, ожоги.
4. Заболевания печени (активный гепатит, цирроз печени).
5. Хронический лимфолейкоз.
6. Кандидомикоз.
Снижение фракции гамма-глобулинов:
1. Многочисленные заболевания и состояния, приводящие к истощению иммунной системы.
Синонимы русские
Фракции белка
Синонимы английские
Serum Protein Electrophoresis
Источник
Рассматриваемый недуг является системным заболеваниям, при котором в различных органах и тканях накапливается особое вещество – амилоид, что вызывает серьезные нарушения в работе организма. В норме указанный белково-полисахаридный комплекс в организме отсутствует, однако его появление может быть вызвано рядом иных патологий, перечень которых будет рассмотрен в данной статье.
Амилоидоз диагностируют приблизительно в 1 случае из 50 тыс. преимущественно у лиц, после 50-летнего возраста. Для постановки точного диагноза необходимо проводить биопсию пораженных тканей.
Что такое амилоидоз – классификация форм амилоидоза, стадии заболевания
В медицинских источниках рассматриваемый недуг классифицируют следующим образом:
1. Исходя из этиологии заболевания:
1) Первичный или идиопатический. Амилоид сосредотачивается в нескольких тканях, и вредоносно влияет на нервные окончания, мышечную ткань, сердечно-сосудистую систему, кожу. Точная причина развития данного типа амилоидоза по сей день не установлена.
2) Вторичный. Его также именуют приобретенным либо реактивным. Является осложнением иных болезней, что имеют воспалительную природу. Амилоидоз может дать о себе знать через несколько десятков лет после начала основного недуга. Изначально начинают беспокоить те органы и/или системы, в которых скопилось больше всего амилоида. По прошествии определенного количества времени в патологический процесс вовлекаются остальные внутренние органы, что, как правило, приводит к летальному исходу.
3) Наследственный. В некоторой литературе данный вид амилоидоза также называют семейным, или генетическим. Основная причина такого вида амилоидоза – аномальные изменения в клетках иммунной системы, что имеют генетическую природу. Его связывают с этнической принадлежностью, а также с местом проживания. В силу этого, различают несколько подвидов генетического амилоидоза:
- Средиземноморская лихорадка. В повышенной зоне риска пребывают арабы, евреи, а также армяне. В моменты обострения у больных сильно повышает температура тела, наблюдаются расстройства пищеварения, боли в суставах и мышцах, психические нарушения.
- Английский амилоидоз. Отличительная черта – серьезные нарушения слуха. В некоторых случаях возможна полная его утрата.
- Американский амилоидоз. Страдают нервы верхних конечностей.
- Португальский амилоидоз. В патологический процесс вовлекается нервная система нижних конечностей, развивается импотенция, наблюдаются нарушения сердечного ритма.
- Финский амилоидоз. Дегенеративные изменения затрагивают почки, органы зрения, а также нервную систему.
4) Старческий. Дает о себе знать у пожилых людей, после достижения ими 80-летнего возраста, и является следствием иных старческих патологий. Выделяют две группы старческого амилоидоза: мозговой и сердечный.

Амилоид в почках — гистология
2. В зависимости от места расположения патологического очага, различают следующие виды амилоидоза:
- Нефропатический. Дегенеративные изменения фиксируются в почках.
- Кардиопатический. Амилоид при указанном состоянии скапливается в структурах сердца.
- Нейропатический. Фиксируются ярко-выраженные сбои в работе нервной системы.
- Гепатопатический. Белково-полисахаридные соединения откладываются в печени.
- Эпинефропатический. В роли патологического очага выступают надпочечники.
- APUD-амилоидоз. Развивается на фоне опухолевых процессов, в результате чего раковые клетки продуцируют фибриллярный белок. Амилоид скапливается не во всем организме, а только в органе, где сформировалось злокачественное новообразование.
- Смешанный.
Некоторые авторы в отдельную группу также выделяют диализный амилоидоз, который формируется вследствие длительного применения «искусственной почки».
Видео: Что такое амилоидоз, чем он опасен, как с ним бороться?
Указанная болезнь в своем развитии проходит 3 основных стадии:
- Доклиническая (латентная). На данном этапе амилоид начинает накапливаться в тех или иных тканях, не провоцируя каких-либо симптомов. Подобное явление может занять 10-15 лет.
- Стадия проявления недуга. Занимает несколько лет, и при отсутствии адекватного лечения может привести к заключительной стадии.
- Необратимые изменения в структуре пораженных органов.
Причины амилоидоза – кто в группе риска?
Спровоцировать рассматриваемое заболевания могут следующие патологические состояния:
- Миеломная болезнь. Плазмоциты при данной патологии видоизменяются и продуцируют атипичные глобулины. Амилоид образовывается вследствие вступления дегенеративных глобулинов в химическую реакцию с нуклепротеидами плазмы.
- Онкопатологии крови.
- Инфицирование органов дыхательной системы, почек, что приобретает хронический характер: туберкулез, пиелонефрит.
- Малярия.
- Ревматологические болезни.
- Хронические недуги, которые характеризуются образованием гнойных выделений: остеомиелит и пр.
- Болезнь Альцгеймера. В данном случае, амилоид сосредотачивается в мозговых тканях.
- Острая, либо хроническая почечная недостаточность, при которой больной пребывает в течение нескольких месяцев/лет на гемодиализе.
- Злокачественные новообразования, независимо от места их расположения.
Важным фактором риска развития рассматриваемого недуга является естественное старение организма.
С возрастом люди подвержены некоторым старческим болезням, которые могут повлечь за собой отложение вредоносного вещества в мозговых тканях организма, а также в сердце.
Видео: Амилоидоз почек и периодическая болезнь
Симптомы всех видов амилоидоза – как вовремя заметить опасное заболевание?
Симптоматическая картина указанной патологии отличается своим многообразием, и зависит от нескольких показателей:
- Качества повреждения внутреннего органа.
- Длительности болезни.
- Места скопления амилоида.
Орган, поврежденный амилоидозом | Проявление патологии |
Почки | В своем развитии проходит 4 стадии:
|
Сердце | Симптоматическая картина представлена 3 патологическими явлениями:
|
Печень | Рассматриваемый недуг крайне редко приводит к печеночной недостаточности. Среди главных признаков амилоидоза печени стоит выделить:
Желтуха при указанной разновидности амилоидоза встречается редко, и она обусловлена погрешностями в функционировании желчевыводящих путей. В этом случае больной будет жаловаться на сильный зуд кожи. |
Желудочно-кишечный тракт | Нарушения со стороны кишечника и желудка являются неотъемлемой составляющей генерализованных форм амилоидоза. Со стороны пациента присутствуют жалобы на:
|
Нервная система | Симптоматика в данном случае определяется видом пораженных нервных волокон. Если затронуты периферические нервы, как это бывает при семейных формах амилоидоза, нижние и верхние конечности частично/полностью утрачивают чувствительность, болят, зудят. Не исключен паралич отдельных участков тела. |
Кожа | Симптоматическая картина представлена шелушением, изменением окраса кожи (на бледно-желтый), зудом, высыпаниями. На лице, шее, а также естественных кожных складках образуются мелкие папулы/узелки красного или желтого цвета. Со временем они могут сливаться, вовлекая все больший участок кожи в дегенеративные изменения. |
Опорно-двигательный аппарат | Со стороны больного наблюдаются жалобы на мышечную слабость и боль в суставах. Кожа, в районе болезнетворных участков становится красной и «горит». Пораженные суставы плохо выполняют свою основную функцию. В целом, амилоидоз опорно-двигательной системы по своей симптоматике очень схож с симметрическим полиартритом. |

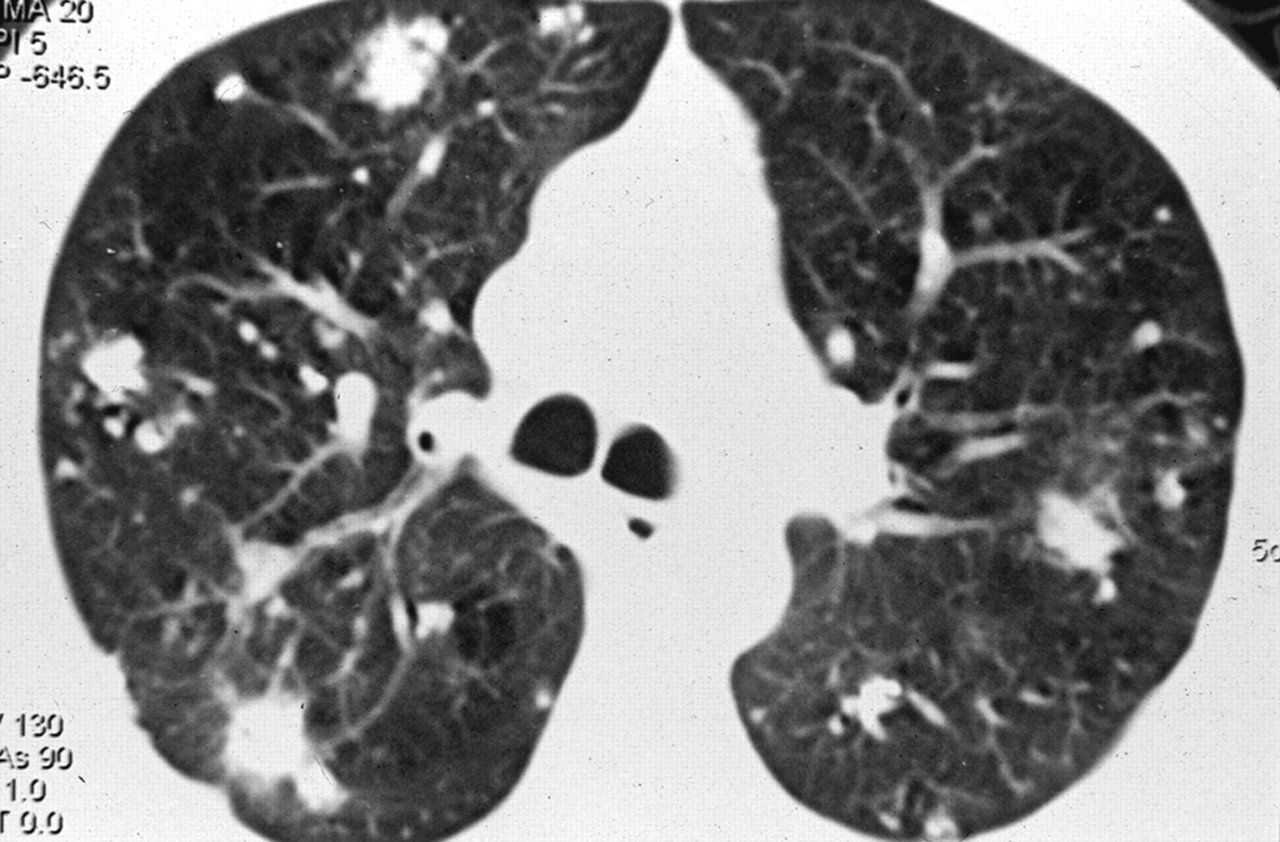
Амилоидоз легких на рентгенограмме
Все методы диагностики амилоидоза сегодня
Диагностика рассматривающего недуга предусматривает следующие мероприятия:
- Беседа с больным по поводу длительности тревожных симптомов. На данном этапе важно выяснить, имела ли место какая-либо инфекционная патология незадолго до появления жалоб.
- Анализ истории болезни и условий проживания/работы пациента. Врач интересуется о наличии в прошлом ревматических заболеваний, сифилиса, туберкулеза, остеомиелита и пр.
- Первичный осмотр больного: измерение артериального давления и пульса; изучение состояния кожных и слизистых покровов, языка; пальпация живота.
- Клиническое тестирование образцов крови и мочи. При амилоидозе повышается уровень гемоглобина, лейкоцитов, ускоряется СОЭ. Концентрация тромбоцитов в крови снижается. Моча при амилоидозе почек и жкт содержит белок, лейкоциты, кровь, а также слизь.
- Биохимический анализ крови на уровень белков, креатинина, мочевины, а также холестерина.
- Ультразвуковая диагностика внутренних органов. Дает возможность оценить их структуру и качество функционирования. Посредством данной методики можно изучить структуру печени, селезенки, органов желудочно-кишечного-тракта, сердца, крупных сосудов.
- Рентгенография с барием. Актуальна при подозрении на амилоидоз кишечника. Посредством указанной методики можно оценить уровень проходимости кишечника, выявить суженные участки, дефекты в структуре кишки.
- Биопсия пораженного органа – золотой стандарт в диагностике амилоидоза. Забор необходимого материала можно производить из слизистой желудка, лимфоузла, почки, прямой кишки, десны, печени, мышечной ткани, селезенки, а также иных органов.
Источник